
| A. | 乙烯使溴水褪色,乙醇使酸性KMnO4溶液褪色,两者化学反应类型相同 | |
| B. | 1mol乙烯和Cl2完全加成后,再与Cl2彻底取代,两过程共消耗5mol Cl2 | |
| C. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| D. | 共价化合物中一定含有共价键,可能含有离子键 |
分析 A.乙烯含双键与溴水发生加成反应,乙醇使酸性KMnO4溶液褪色发生氧化反应;
B.1:1发生加成反应,乙烯中含4个H,可发生取代反应;
C.v=$\frac{△c}{△t}$;
D.含离子键的一定为离子化合物.
解答 解:A.乙烯含双键与溴水发生加成反应,乙醇使酸性KMnO4溶液褪色发生氧化反应,则两个反应类型不同,故A错误;
B.1:1发生加成反应,乙烯中含4个H,可发生取代反应,则1mol乙烯和Cl2完全加成后,再与Cl2彻底取代,两过程共消耗1mol+4mol=5mol Cl2,故B正确;
C.化学反应速率通常用单位时间内生成或消耗某物质的浓度变化的多少来表示,而不是质量变化,故C错误
D.含离子键的一定为离子化合物,则共价化合物中一定含共价键,一定不含离子键,故D错误;
故选B.
点评 本题考查较综合,涉及有机物的结构与性质、化学反应速率及化学键等,注重高频考点的考查,把握结构与性质的关系、相关化学反应原理为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要加入过量的氧气 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 废电池需回收,主要是要利用电池外壳的金属材料 | |
| D. | 升高温度可降低活化能,增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
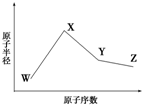 已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
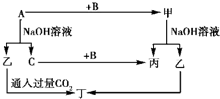 A、B、C是单质,其中A是金属,各种物质间的转化关系如图所示.
A、B、C是单质,其中A是金属,各种物质间的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .c(Na+)=c(HB-)+2c(B2-)+c(OH-) | B. | .c(Na+)=0.1mol•L-1≥c(B2-) | ||
| C. | .c(H+)•c(OH-)=10-14 | D. | 此溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有甲烷和乙烯(C2H4) | ||
| C. | 可能有乙烷(C2H6) | D. | 一定有乙炔(C2H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 石灰氰,是由氰氨化钙(CaCN2)、氧化钙和其他不溶性杂质构成的混合物.呈灰黑色,有特殊臭味.是一种碱性肥料,也是高效低毒多菌灵农药的主要原料之一,可用作除草剂、杀菌剂、杀虫剂等,可用于生产双氰胺、三聚氰胺和氰熔体等.
石灰氰,是由氰氨化钙(CaCN2)、氧化钙和其他不溶性杂质构成的混合物.呈灰黑色,有特殊臭味.是一种碱性肥料,也是高效低毒多菌灵农药的主要原料之一,可用作除草剂、杀菌剂、杀虫剂等,可用于生产双氰胺、三聚氰胺和氰熔体等.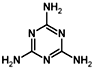 )俗称“蛋白精”,也可由氰氨化钙制得.在三聚氰胺分子中含有的σ键和π键数目之比为5:1.
)俗称“蛋白精”,也可由氰氨化钙制得.在三聚氰胺分子中含有的σ键和π键数目之比为5:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com