
| A. | 它们相差一个电子层 | B. | 它们的化学性质相似 | ||
| C. | 钠原子,钠离子均为同一元素 | D. | 它们的最外层电子数不同 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L二氯甲烷( CH2Cl2)所含的分子数为0.5NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 1mol羟基(-OH)所含的电子总数为10NA | |
| D. | 10g质量分数为46%的乙醇溶液中,氢原子的总数为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{12}^{24}$Mg和${\;}_{12}^{26}$Mg互为同位素 | B. | 氯原子的结构示意图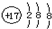 | ||
| C. | 氯化钠的电子式是 | D. | 乙酸与乙醇互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
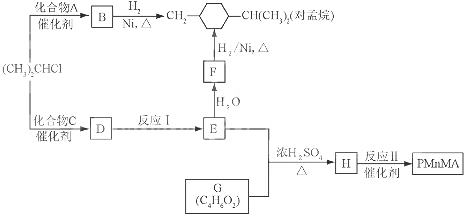

 ,
,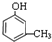
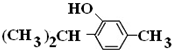 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$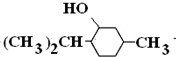
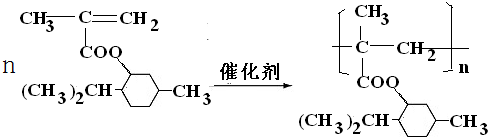 ;.
;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+和SO42- | B. | K+和SO42- | C. | Cu2+和Cl- | D. | Ag+和NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将12.00g胆矾配成500mL溶液 | |
| B. | 将12.50g胆矾溶于少量水中,再用水稀释至500mL | |
| C. | 称取7.68g硫酸铜,加入500mL水 | |
| D. | 在80mL0.6mol/L CuSO4溶液中加入400mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com