
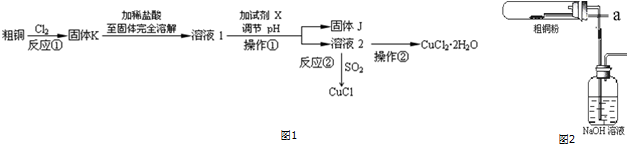
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)操作①是分离固体和液体混合物的操作;溶液2中若含有杂质离子则是Fe3+,用KSCN溶液或苯酚检验;
(2)氯化铜、氯化铁在溶液中会发生水解,铜盐水解生成氢氧化铜,保持溶液呈强酸性,避免铜离子水解损失,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀;
(3)根据信息可知:SO2与铜离子反应生成CuCl白色沉淀和SO42-;
(4)①Cu与Cl2反应产生大量棕黄色烟(CuCl2);
②正极上ClO-得电子生成Cl-.
解答 解:粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)操作①是分离固体和液体混合物的操作,所以操作①的名称是过滤,溶液2中若含有杂质离子则是Fe3+,用KSCN溶液或苯酚检验,
故答案为:过滤;KSCN溶液或苯酚;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的盐酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质,
故答案为:抑制氯化铜、氯化铁水解;c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(4)①Cu与Cl2反应产生大量棕黄色烟(CuCl2),则反应时盛粗铜粉的试管中的现象是产生大量棕黄色烟,
故答案为:产生大量棕黄色烟;
②反应后,盛有NaOH溶液的广口瓶中生成NaClO溶液,该溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,ClO-得电子作正极生成Cl-,则正极上的电极方程式为:ClO-+2e-+H2O=Cl-+2OH-,
故答案为:ClO-+2e-+H2O=Cl-+2OH-.
点评 本题以实验室制备氯化铜为背景,考查了物质的制备实验操作、离子检验、除杂质、离子方程式的书写、原电池原理的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 除④⑦外 | B. | 除③⑥外 | C. | ①②⑤ | D. | 除④外 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
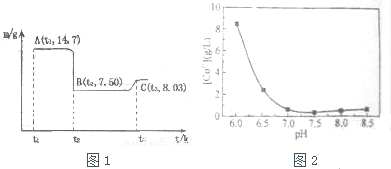
| 开始沉淀的pH | 完全溶解的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

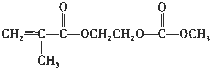 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:
,写出该单体与足量氢氧化钠溶液反应的化学方程式: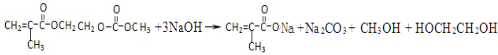 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
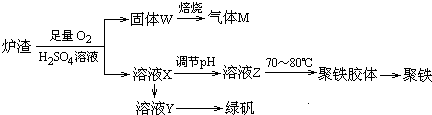
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于测定一些文物的年代,该过程是化学变化 | |
| B. | 烧结粘土制陶瓷是物理变化 | |
| C. | 服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒是复分解反应 | |
| D. | 从海水中提取镁的过程中,发生的是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
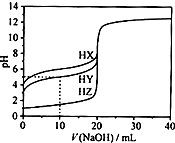 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的酸性强弱顺序:HZ<HY<HX | |
| B. | HZ、HY、HX均为弱酸 | |
| C. | 向HY溶液中加入10.00mLNaOH溶液,一定有c(Y-)+c(OH-)═c(H+)+c(Na+) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
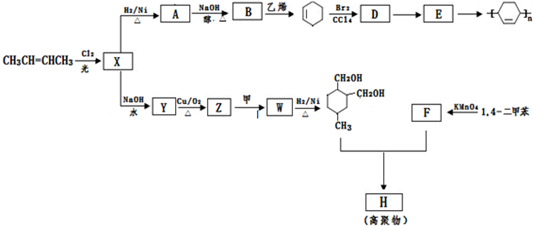
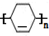
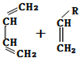 →
→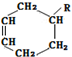 (或写成
(或写成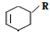 R代表取代基或氢)
R代表取代基或氢)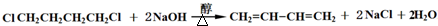 ;
;
 ;
;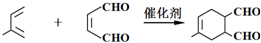 .
.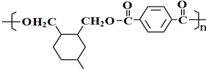 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com