
����Ŀ��ʵ��������NaOH��������1.0 mol/L��NaOH��Һ240 mL��
(1)������Һʱ��һ����Է�Ϊ���¼������裺
�ٳ������ڼ��㡡���ܽ⡡��ҡ�ȡ���ת�ơ���ϴ�ӡ��߶��ݡ�����ȴ��
����ȷ�IJ���˳��Ϊ__________________________________��
��ʵ������õ�����������ƽ��ҩ�ס����������ձ���____________________��
(2)ijͬѧ������NaOH��������������������ƽ�����ձ�����������ƽƽ����״̬����ͼ��ʾ���ձ���ʵ������Ϊ________g��Ҫ��ɱ�ʵ���ͬѧӦ�Ƴ�________g NaOH��
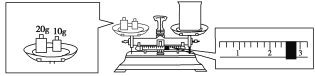
(3)���ж�����ƿ����ʹ�÷�������������ȷ������____��
A������ƿ�ϱ����ݻ����¶Ⱥ�Ũ��
B������ƿ������ˮϴ��������
C��������Һʱ�������õ�Ũ����С�ĵ�������ƿ�У���������ˮ���ӽ��̶���1��2 cm�������ý�ͷ�ιܵμ�����ˮ���̶���
D��ʹ��ǰҪ�������ƿ�Ƿ�©ˮ
(4)�����ƹ����У���������������ȷ�ģ����в������������ƫ�ߵ���_______________��
��ת����Һʱ������������������ƿ����
�ڶ���ʱ���ӿ̶���
��δ��ȴ�����¾ͽ���Һת�Ƶ�����ƿ������
�ܶ��ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶���
���𰸡��ڢ٢ۢ�ݢޢߢ� 250 mL����ƿ����ͷ�ι� 27.4 10.0 D �ڢ�
��������
(1)��������һ�����ʵ���Ũ����Һ�IJ��輰��ʹ�õ������ش�
(2)������ƽ����ȷ�����ǡ��������롱���ôγ�����������ձ��ŷ��ˣ���ʱ�ձ���ʵ������=20g+10g-2.6g=27.4g����ʵ��Ӧѡ��250mL����ƿ��Ӧ������NaOH����=0.25L��1mol/L��40g/mol=10.0g��
(3)����ƿ��һ����С��̶��ߡ������ݻ��������¶ȡ��ȣ�����������ƿ���ܽ����ʣ�����ƿϴ���غ�ɣ�ʹ������ƿǰҪ�������Ƿ�©Һ��ֻ�в�©Һ������ƿ����ʹ�ã�
(4)����һ�����ʵ���Ũ����Һʱ�����ݴ�������������ĸ���������V��nB���ı仯�������ݹ�ʽ![]() ������ʵ��Ũ�ȵ�Ӱ����
������ʵ��Ũ�ȵ�Ӱ����
(1)����һ�����ʵ���Ũ����Һʱ����Ҫ���У����㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȣ���ȷ�����Ǣڢ٢ۢ�ݢޢߢܡ���ʵ������õ�����������ƽ��ҩ�ס����������ձ����250mL����ƿ����ͷ�ι���
(2)�ôγ�����������ձ��ŷ��ˣ���ʱ�ձ���ʵ������=20g+10g-2.6g=27.4g����ʵ��Ӧѡ��250mL����ƿ��Ӧ������NaOH����=0.25L��1mol/L��40g/mol=10.0g��
(3)A.����ƿ�ľ��������п̶��ߣ�����ƿ��û�С�Ũ�ȡ���ʶ��A�����
B.����ƿ������ˮϴ���غ�ɣ���Ӱ��������Һ��Ũ�ȣ�B�����
C.����ƿ�������ȣ�Ϊ��֤������Һ��ȷ�Ժ�ʵ��İ�ȫ�ԣ�����ƿ�в����ܽ��κ����ʣ�C�����
D. ���ƹ�������Ҫ����ƿ�����µߵ�ҡ�ȣ����©Һ����Ӱ��Ũ�ȵ�ȷ�ԣ����ҿ������ʵ���ߵ������˺�������ʹ��ǰҪ�������ƿ�Ƿ�©ˮ��D����ȷ����ѡD��
(4)��ת����Һʱ������������������ƿ�⣬ʹ���ʵ����ʵ�����![]() ����С������
����С������![]() ��֪��ʵ��Ũ��ƫ�ͣ�������ڶ���ʱ���ӿ̶��ߣ�ʹ����ƿ��Һ����ڿ̶��ߣ������Һ�����V����С������
��֪��ʵ��Ũ��ƫ�ͣ�������ڶ���ʱ���ӿ̶��ߣ�ʹ����ƿ��Һ����ڿ̶��ߣ������Һ�����V����С������![]() ��֪��ʵ��Ũ��ƫ�ߣ�������ȷ������NaOH����ˮ���ȣ�δ��ȴ�����¾ͽ���Һת�Ƶ�����ƿ�����ݣ�������������������ʱ��Һ�����V������С������
��֪��ʵ��Ũ��ƫ�ߣ�������ȷ������NaOH����ˮ���ȣ�δ��ȴ�����¾ͽ���Һת�Ƶ�����ƿ�����ݣ�������������������ʱ��Һ�����V������С������![]() ��֪��ʵ��Ũ��ƫ�ߣ�������ȷ����Һ����ڿ̶��ߣ�����������ƿ�Ŀ̶����Ϸ����ڱ���մ��������Һ���Ե�ʣ���Ӱ��������Һ��Ũ�ȣ�����ټ�ˮ���̶��ߣ��ͻ�ʹ��Һ�����V��������
��֪��ʵ��Ũ��ƫ�ߣ�������ȷ����Һ����ڿ̶��ߣ�����������ƿ�Ŀ̶����Ϸ����ڱ���մ��������Һ���Ե�ʣ���Ӱ��������Һ��Ũ�ȣ�����ټ�ˮ���̶��ߣ��ͻ�ʹ��Һ�����V��������![]() ��֪��ʵ��Ũ��ƫС���������ѡ�ڢۡ�
��֪��ʵ��Ũ��ƫС���������ѡ�ڢۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�Ķ������������������ϣ�
����һ
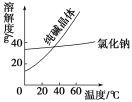
���϶�
���� | �۵�/�� | �е�/�� | �ܶ�/ g/cm3 | �ܽ��� |
�Ҷ���(C2H6O2) | ��11.5 | 198 | 1.11 | ������ˮ���Ҵ� |
������(C3H8O3) | 17.9 | 290 | 1.26 | �ܸ�ˮ���ƾ�������Ȼ��� |
�ش���������(����ĸ���)��
��1���Ӻ�����NaCl��Na2CO3���ᴿNa2CO3�IJ���Ϊ�ܽ⡢_________��________�����ˡ�ϴ�ӡ�����
��2�����Ҷ����ͱ�������������ѷ�����_________��
A��������������B����ȡ�� C���ᾧ�� D����Һ��
II.����������õĵֿ�ű����ҩ��ɴӻƻ��ᆬҶ����ȡ��������ɫ��״���壬�������Ҵ������ѵ��л��ܼ���������ˮ����������ȡ��������
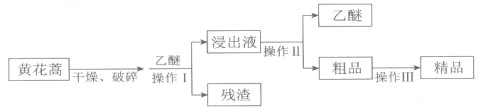
����I��II�У������õ���װ����________������ţ���
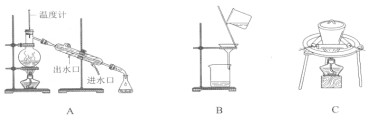
��.ʵ������98%���ܶ�Ϊ1.84g/cm3��Ũ��������0.2mol/L��H2SO4��Һ470mL.
��1����Ҫʹ�õ���Ҫ��������Ͳ���ձ�����������___________��__________��
��2�����������ɷֽ�Ϊ���¼�����
A������Ͳ��ȡ______mLŨ���ᣬ����ע��װ��Լ50mL����ˮ���ձ�����ò��������衣
B������������ˮ������ϴ���ձ��Ͳ���������ÿ�ε�ϴҺ����������ƿ�
C����ϡ�ͺ������С�ĵ��ò�������������ƿ�
D���������ƿ�Ƿ�©ˮ��
E��������ˮֱ�Ӽ�������ƿ����Һ��ӽ��̶���1-2cm����
F���ǽ�ƿ���������ߵ���ҡ����Һ��
G���ý�ͷ�ι�������ƿ����μ�������ˮ����Һ����͵�ǡ����������С�
��ݴ���д��
��������������еĿհ״���
�ڲ��������ȷ�IJ���˳������ĸ��д����____________
�� D ������ A ���� �� �� �� ���� F ����
��3�����в�����ʹ����ϡ����Ũ��ƫ�ߵ���______________��
A��ȡ��Ũ����ʱ���ӿ̶���
B������ƿ������ˮϴ�Ӻ���1.2mol/L��������ϴ
C��ת����Һʱ��������������Һ����
D������ʱ��������ƿ�̶���
E����ϡ�ͺ��ϡ��������ת������ƿ�ҽ��к����ʵ�����
F�����ݺ�����ƿ����ҡ�ȣ����ź���Һ����ڿ̶��ߣ��ֲ��伸�� ����ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ����������ȷ����( )
A.���ӻ�������ֻ�����Ӽ�
B.���ۻ�����һ���������Ӽ�
C.���ӻ�����һ���������ۼ�
D.���ۻ�������ܺ������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д���пհף�
(1)����6.02��1023��H��H2O�������ʵ�����________mol��ij��������Һ�к���3.01��1023��Na+������Һ��SO42-�����ʵ����� ____________mol������Һ��Na2SO4������Ϊ ______________g��
(2)_____________mol H2O�к��е���ԭ������1.5 mol CO2�к��е���ԭ������ȡ�
(3)�������ʵ�����NH3��CH4��ϣ����������NH3��CH4��������Ϊ______________��
(4)��֪16gA��20gBǡ����ȫ��Ӧ����0.04molC��31.76gD����C��Ħ������Ϊ ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
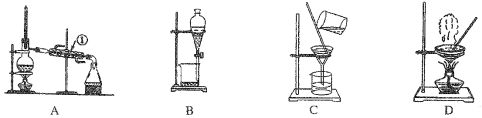
��1�����Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��___________�������װ��ͼ����ĸ����ͬ������ȥ����ˮ�е�C1-�����ʣ�ѡ��װ��_____________��
��2���ӵ�ˮ�з����I2��ѡ��װ��__________���÷��뷽��������Ϊ__________________��
��3��װ��A�Тٵ�������______________����ˮ�ķ����Ǵ�__________����ϡ����¡� ���ڽ�ˮ��װ��B�ڷ�ҺʱΪʹҺ��˳�����£��Ƚ��еIJ�����________________________________�����ٴ��¶˻�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������̼��ĵ���ƽ�ⳣ���ֱ�Ϊ
H2S�� ![]()
![]()
H2CO3�� ![]()
![]()
��ش���������:
��1�������£�0.1mol��L-1��������Һ��0.1mol��L-1��̼������Һ�����Ը�ǿ����_________________����ԭ����______________________________________________��
��2����ZnSO4��Һ�еμӱ���H2S��Һ��û�г������ɣ������μӡ������İ�ˮ������ZnS�������õ���ƽ��ԭ��������������___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ������ʲô���ؾ������������� ������ķ��Ӷ��� ��������ӵĴ�С
��������Ӽ��ƽ������ ��������ӵ���Է���������
A.�٢�
B.�٢�
C.�ڢ�
D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4) ������ˮ�����ȷֽ�����������������صĹ�ҵ�Ʒ��ж��֣�����һ�ֵ���Ҫ������ͼ��ʾ(������Ϊ������)��
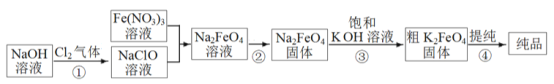
��1�����з�Ӧ�����ӷ���ʽ��_____________________________��
��2�����еķ�ӦΪ: Na2FeO4(s)+2KOH(aq) ![]() K2FeO4(s)+2NaOH(aq)�������ɸ�����صĿ���ԭ����____________���ñ���KOH ��Һ��Ŀ�ij��˼���K2FeO4���ܽ��⣬����_____________��
K2FeO4(s)+2NaOH(aq)�������ɸ�����صĿ���ԭ����____________���ñ���KOH ��Һ��Ŀ�ij��˼���K2FeO4���ܽ��⣬����_____________��
��3�� �ᴿ��K2FeO4���õķ�����___________________(ѡ������ȡ�����������������ؽᾧ��)���ᴿ�������ܽ��K2FeO4 ����Ӧѡ��__________(�����)��
A.ˮ B.ϡ���� C.KOH ��Һ D.NaOH ��Һ
��4��ij�¶��£����������Һ�ڲ�ͬpH �µķֽ�������ͼ��ʾ��Ϊ�ӳ����������Һ�ı���ʱ�䣬�ɲ�ȡ�Ĵ�ʩ��________________�����pH>7 ʱ�Ļ�ѧ��Ӧ����ʽ��ƽ:__ K2FeO4 +___=___KOH+___Fe(OH)3��+________��____________________
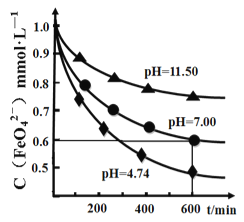
��5���ø�����ش�����ˮ����ȥ�ۡ�ɱ��������������������ԭ���ɵ�Fe3+ˮ������Fe(OH)3���塣�������ֱַ��������ǡ��ױ����˹���ˮ��ÿ���ֱ����30mg K2FeO4����ͬ�¶�������ȥ��Ч�����±���
��Ŀ | ��������Һ | �ױ���Һ |
��ʼCOD/(mg��L-1) | 1124 | 1966 |
������COD/(mg��L-1) | 983 | 526 |
ȥ����/% | 11.54 | 73.24 |
��֪: ��ѧ������(COD) ָ����: ��һ�������£�������1��ˮ���л�ԭ�����������ĵ�����������Ϊָ�꣬�����ÿ��ˮ��ȫ������������Ҫ�����������������mg��L-1��ʾ����ָ��Ҳ��Ϊ��ˮ���л��ﺬ�����ۺ�ָ��֮һ���ɼױ������1L ��ˮ����ȥ����Ϊ73.24%ʱ����������������_____mg��[ ��֪ :M(K2FeO4)=198g/mol]����������Ҫ��m (Na2FeO4 ) ����ʵ��������˵��Na2FeO4 ȥ���л���ˮ��ԭ���������������⣬��һ��ԭ�������_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ļ�ѧ�����У���ȷ����
A. ��ʯī���缫���AlCl3��Һ:2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
B. �ڸ�������ﯵĻ����£�CO��ȼ�ϵ�صĸ�����Ӧ2CO+2O2--4e-=2CO2
C. ���Ƶ�ˮ�ⷽ��ʽ:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. ���������ˮ��Һ��������Ӧ:2H++2e-=H2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com