
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1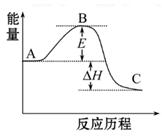
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
下列说法错误的是
| A.化学反应除了生成新的物质外,还伴随着能量的变化 |
| B.物质的燃烧一定是放热反应 |
| C.放热的化学反应不需要加热就能发生 |
| D.化学能与光能之间可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)甲醇(CH3OH)被称为21世纪的新型燃料,以煤为原料制备甲醇的流程如下: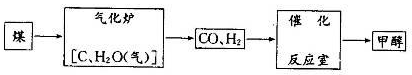
(1) 气化炉中主要反应的化学方程式为 。
(2)已知CO、H2、甲醇(l)的燃烧热分别为:—285.8 kJ/mol、—283 kJ/mol、—726.5 kJ/mol;
则CO和H2合成甲醇的热化学方程式为__ __
(3) -定条件下,在催化反应室中发生反应.CO(g)+2H2(g) =CH3OH(g)△H<0;
CO 的平衡转化率与温度、压强的关系如图所示。回答下列问题: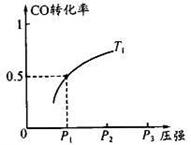
①工业上,上述反应温度不宜过高,原因是_ ___;
②若反应是1 mol CO与2 mol H2在2L容积中进行,则
T1、P1下,该反应的平衡常数为__ __;
维持温度、容积不变,催化反应室再增加l mol CO与2 mol
H2,达到新平衡时,CO的转化率____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_________________________________________________。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
 Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: 。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键
能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H= kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=____________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=” 或“<” )。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+)
c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ ·mol-1 | 436 | 498 | X |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)化学在生活中有很多的应用,如臭氧可用于空气净化、饮用水消毒、工业废物处理和作为漂白剂等,氮化硅(Si3N4)是一种新型陶瓷材料,具有较高的硬度且耐高温。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。已知: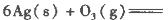
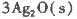 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为
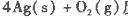 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
(2)氮化硅()可由石英与焦炭在高温的氯气流中通过如下反应制得: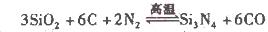
在VL的密闭容器中进行反应,实验数据如下表: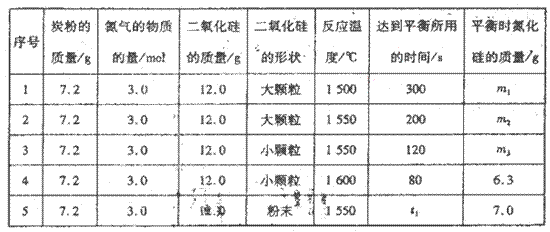
①实验l和实验2表明,________对反应速率有影响,对同一规律研究的实验还有一组是________(填实验序号)。本实验还研究了_______对反应速率的影响。。
②实验5中,t1________(填“>”、“<”或“=”)120,平衡时,二氧化硅的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。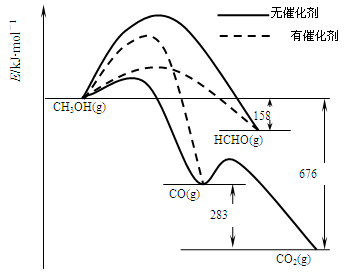
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)
△H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为
g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。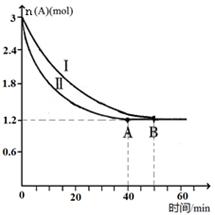
①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表 示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5mol?L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol?L-1的HCN溶液的pH=_________。
(4)对于0.1mol?L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com