
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJ/mol |
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到化学平衡时,正、逆反应速率都为零 | |
| D. | 化学反应中,纯液体物质不能计算其速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制取
制取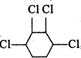 ,即
,即
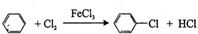 ;⑤
;⑤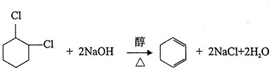 ;⑥
;⑥ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①需要使用普通漏斗 | B. | 步骤②要使用分液漏斗 | ||
| C. | 步骤③要用到坩埚 | D. | 步骤④需要蒸馏装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
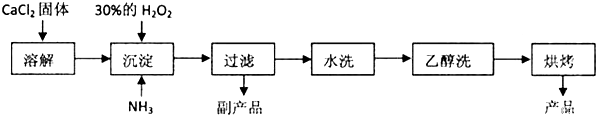
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
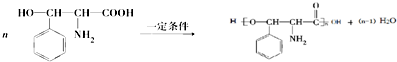 .
.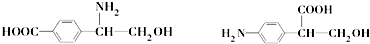
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y=5 | B. | x+y=7 | C. | x+y=11 | D. | x+y=13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com