
【题目】某新型可充电电池构造如图所示,工作时(需先引发Fe 和KClO3的反应,从而使 LiCl-KCl共晶盐熔化),某电极(记为X )的反应式之一为:xLi++ xe- +LiV3O8=Lii+xV3O8。下列说法正确的是
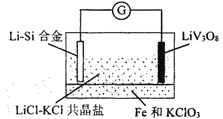
A.放电时,正极的电极反应式为: Li – e- = Li+
B.放电时,总反应式为:xLi + LiV3O8 = Lii+xV3O8
C.充电时,X电极与外接电源负极相连
D.充电时,X电极的质量增加
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】间氯苯甲醛是新型农药、医药等有机合成的中间体,是重要的有机化工产品。实验室制取间氯苯甲醛的过程如下。
Ⅰ.Cl2的制备
舍勒发现氯气的方法至今还用于实验室制备氯气。本实验中利用该方法制备Cl2。
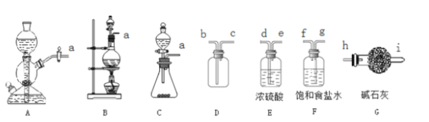
(1)该方法可以选择图中的_____(填字母标号)为Cl2发生装置,反应中氧化剂和还原剂的物质的量之比为_______。
(2)选择图中的装置收集一瓶纯净干燥的Cl2,接口的连接顺序为a→___________(按气流方向,填小写字母标号)
(3)试用平衡移动原理解释用饱和食盐水除去Cl2中混有的HCl的原因:_____________________。
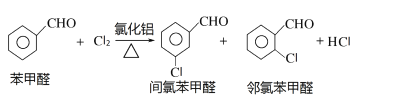
Ⅱ.间氯苯甲醛的制备
反应原理:
实验装置和流程如图所示:
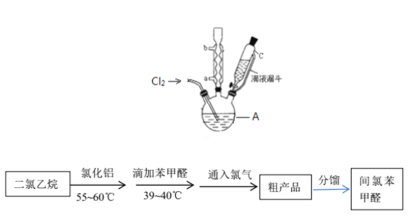
(4)图中仪器A的名称是_____________。
(5)间氯苯甲醛的制备过程中,二氯乙烷的作用是________________________;该实验要求无水操作,理由是____________________________________________;该实验有两次恒温过程,为控制反应温度仪器A处可采用________加热的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.9 g Mg、Al合金溶于一定物质的量浓度的HCl溶液400 mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀。如果加入一定量的NaOH溶液至沉淀量最大时,溶液的总体积刚好为合金溶解时体积的两倍,假设完全反应(不考虑体积变化),试求:
(1)生成的沉淀的最大值是多少_________?
(2)原合金中Mg的质量百分含量_________(计算结果保留一位小数点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、秋冬季节是流感发作的高峰期,“84消毒液”能有效杀灭流感病毒。巴蜀中学某同学购买的“84消毒液”瓶体部分标签如图所示,通常稀释100倍(体积比)后使用。请回答下列问题:
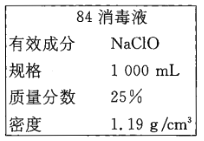
(1)该“84消毒液”的物质的量浓度约为______mol/L。
(2)该同学参阅“84消毒液”的配方,欲用NaClO固体配制250mL上述浓度的消毒液:
①需要用托盘天平称量NaClO固体的质量为_______g。
②实验中所用的玻璃仪器除烧杯、玻璃棒、量筒外,还有_____________。
(3)实验过程中下列操作或说法不正确的是_____。
A、容量瓶用蒸馏水洗净之后,应烘干后才能用于溶液的配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致所得溶液浓度偏低
C、定容时,俯视刻度线会导致所得溶液浓度偏低
D、摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
(4)经过查阅资料,测定所配消毒液中NaClO的物质的量浓度的方法如下:准确取出10.00mL消毒液稀释至1000.00mL,量取稀释液20.00mL于锥形瓶中,加入过量的NaI溶液,用足量的醋酸酸化,充分反应后向溶液中滴加0.0500 mol/L Na2S2O3溶液,完全反应时消耗Na2S2O3溶液30.40mL。反应过程中的相关化学方程式为: ![]()
![]() ,通过计算求出所配消毒液中NaClO的物质的量浓度为___________mol/L 。(保留两位有效数字)
,通过计算求出所配消毒液中NaClO的物质的量浓度为___________mol/L 。(保留两位有效数字)
Ⅱ、某工厂的工业废水中含有大量FeSO4,较多的CuSO4和少量的Na2SO4,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。请根据下列流程,完成实验方案(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液)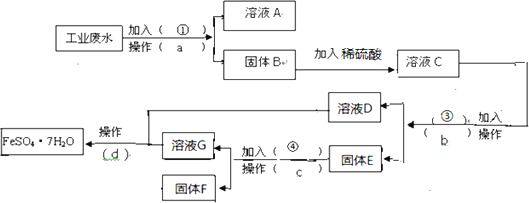
(1)操作a的名称为____,所需的玻璃仪器有_____。
(2)固体E的成分为____(填化学式),加入的试剂④为_________。
(3)加入试剂①的目的是__________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为_______,过滤,洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.N2电子式为![]()
B.Cl-的结构示意图为![]()
C.CO2的结构式为O—C—O
D.氯化镁的电子式:Mg2+[C![]() ]
]![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池的工作原理如下图所示。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
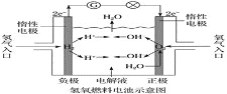
(1)酸式电池的电极反应:负极:___________________________________,正极:________________________________________________________;电池总反应:________________________________________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:负极:_______________________________________,正极:______________________________________________________;电池总反应:____________________________________________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是质子数依次增大的短周期主族元素,它们形成的某种化合物Q的结构式如图所示。X与W形成的化合物M常温下是液体。下列说法正确的是
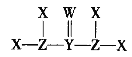
A.X与Z可形成质子数、电子数均相同的ZX3、![]()
B.M热稳定性强且具有弱氧化性
C.Q分子中各原子最外电子层均达到稳定结构
D.X、Y、Z、W四种元素间只能形成共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com