
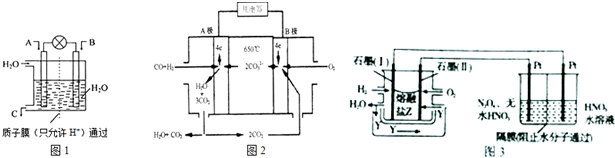
分析 (1)①燃料电池中,通入氧化剂的电极是正极、通入还原剂的电极是负极,该反应中C元素化合价由+2价变为-2价、H元素化合价由0价变为+1价,所以CO是氧化剂;
②若A为SO2,B为O2,C为H2SO4,负极上二氧化硫失电子和水反应生成硫酸根离子和氢离子;
③若A为NH3,B为O2,C为HNO3,则正极发生还原反应;
(2)①该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,正极上是氧气得电子的还原反应,总反应等于两极上的反应之和;
②依据消耗的氧气的量计算转移电子数,依据转移电子守恒,计算生成银的质量,根据消耗氢氧根计算氢离子浓度,从而计算pH;
(3)①在正极上,氧气得电子生成的氧离子可以和二氧化碳结合为碳酸根离子;
②先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式.
解答 解:(1)①燃料电池中,通入氧化剂的电极是正极、通入还原剂的电极是负极,该反应中C元素化合价由+2价变为-2价、H元素化合价由0价变为+1价,所以CO是氧化剂,则通入CO的电极为正极,故答案为:正;
②若A为SO2,B为O2,C为H2SO4,负极上二氧化硫失电子和水反应生成硫酸根离子和氢离子,电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
③若A为NH3,B为O2,C为HNO3,则正极发生还原反应,氧气得电子生成水,电极方程式为O2+4e-+4H+═2H2O,故答案为:O2+4e-+4H+═2H2O;
(2)①该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,正极上是氧气得电子的还原反应,电池总反应为一氧化碳、氢气与氧气反应生成二氧化碳和水,总反应方程式为:CO+H2+O2=CO2+H2O;
故答案为:CO+H2+O2=CO2+H2O;
②电解足量的硝酸银溶液,阳极为氢氧根失电子生成氧气,阴极上发生反应:Ag++e-=Ag,产物的质量为21.6g即0.2mol,转移电子是0.2mol,在阳极上:4OH--4e-=2H2O+O2↑,产生氧气的物质的量是0.05mol,体积是1.12L,则消耗氢氧根的物质的量为0.2mol,则溶液中属于氢离子为0.2mol,浓度为$\frac{0.2mol}{2L}$=1mol/L,所以溶液的pH为1;
故答案为:1.12;1;
(3)①在正极上,氧气得电子生成的氧离子可以和二氧化碳结合为碳酸根离子,可以保持熔融盐的成分不变,故答案为:氧气可以和二氧化碳共同转化为碳酸根离子;可以保持熔融盐的成分不变;
②N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.
故答案为:N2O4+HNO3-2e-=2N2O5+2H+.
点评 本题考查原电池设计、燃料电池等知识点,会根据电池反应式确定正负极及电解质,发生氧化反应的金属作负极、不如负极材料活泼的金属或导电的非金属作正极,发生还原反应的电解质为原电池中电解质,会正确书写电极反应式,为高考高频点.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾[KAl(SO4)2•12H2O]溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
 | 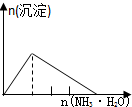 | 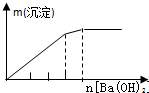 | 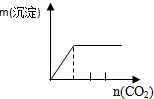 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
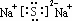 ;其水溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
;其水溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液 | B. | Ba(OH)2溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和NaHCO3溶液中通入过量CO2:CO32-+CO2+H2O═HCO3- | |
| B. | 金属铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO32-═CaCO3↓ | |
| D. | 氯化铝与过量氨水反应:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 萃取 | C. | 液体过滤 | D. | 升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制成合金保护船体 | B. | 是外加电流的阴极保护法 | ||
| C. | 船体的反应:Fe-2e→Fe2+ | D. | 锌块的反应:Zn-2e→Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com