
【题目】下列晶体或分子中,含有化学键类型有差异的一组是( )
A. NH3、NO2 B. MgO、H2O2
C. NaOH、Ca(OH)2 D. NaCl、KF
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。(反应中生成的水已略去)

请回答以下问题:
(1)B是____________,F是____________,G是____________。(填化学式)
(2)C物质在日常生活中可作____________剂。
(3)写出反应①的化学方程式:____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)小丁同学在某次实验中大约需要0.20mol/L的氢氧化钠溶液850 mL,配制时涉及到如下操作:
①轻轻振荡容量瓶(振荡时不能将溶液溢出刻度线外),使溶液充分混合;
②用天平称量纯净的氢氧化钠固体_____________g;
③待烧杯中的溶液冷却后沿玻璃棒小心地注入__________(填容量瓶规格)容量瓶中;
④将容量瓶用瓶塞盖好,反复上下颠倒、摇匀;
⑤将配制好的溶液倒入干燥、洁净的试剂瓶中,贴好标签备用;
⑥将称量好的氢氧化钠固体放入烧杯中,加入适量的蒸馏水使固体完全溶解;
⑦改用___________滴加蒸馏水至溶液的凹液面正好与刻度线相切
⑧用蒸馏水洗涤烧杯内壁2~3次,将每次洗涤后的溶液也都注入容量瓶中
⑨向容量瓶中注入蒸馏水,直到容量瓶中的液面接近容量瓶刻度处1cm~2cm处
请协助小丁同学先完成操作中的空余部分,再在下列选项中选择正确的操作顺序。正确的操作顺序是(_______)。
A.②⑥③④①⑦⑧⑨⑤ B.②⑥③⑧①⑨⑦④⑤
C.②③①④⑥⑦⑧⑨⑤ D.②③①⑥⑦⑧⑨④⑤
(2)下列操作会使所配溶液物质的量浓度偏低的是__________________________。
A.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度
B.定容时向容量瓶中加蒸馏水,超过刻度线,再吸出少许
C.小烧杯、玻璃棒没有洗涤 D.观察容量瓶刻度时仰视
E.所用容量瓶中,已有少量蒸馏水 G.称量时已观察到NaOH吸水
F.在未降至室温时,立即将溶液转移至容量瓶定容
(3)因为NaOH具有腐蚀性,所以称量时,需注意选择用___________盛装NaOH固体;
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有H2SO4的H2O2溶液中滴加一定量的KMnO4溶液,反应开始后,溶液中Mn2+的浓度c将随时间t的变化而变化。某学生在做实验前认为,Mn2+的浓度c与时间t的关系如图甲所示,做完实验后,得到的结果如图乙所示。请回答下列问题:
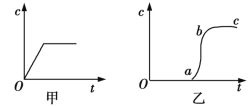
(1)写出H2O2与KMnO4反应的化学方程式 。
(2)Oa段的意义为 。
(3)ab段的意义及ab段陡的原因为 。
(4)bc段的意义为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A. 1L 0.1 moI·L-1氨水中含有OH -数日为0.1NA
B. KIO3与HI溶液反应时.生成0.1molI2转移的电子数为0.2NA
C. l0g D2O和l0g H218O中含有的中子数均为5NA
D. 0.1 mol N2与0.3mol H2通过高温高压催化剂,生成的气体分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,在25 ℃时存在如下平衡:2NO2(g)![]() N2O4(g)ΔH<0,将烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是( )
N2O4(g)ΔH<0,将烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol·L-1的MgCl2溶液中含Cl-的数目为0.2NA
B. 100 g质量分数为46%的乙醇(C2H6O)水溶液中含有的氧原子数为4NA
C. 标准状况下,11.2 L CCl4中含有的分子数为2NA
D. 20 mL 2 mol·L-1 H2O2溶液中,溶质所含电子数为7.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中粒子浓度的关系式中,正确的是( )

A.pH相同的①CH3COONa、②NaHCO3两种溶液中的c(Na+):②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.上图表示用0.1 mol/L CH3COOH溶液滴定20 mL 0.1mol/L NaOH溶液的滴定曲线,则pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.上图a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com