
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | ① | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | / | Zn+Fe2+=Zn2++Fe | ② |
| ③ | 在FeCl3溶液中加入足量铁粉 | ③ | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | ④ | / | / | Fe3+具有氧化性 |
分析 (1)探究铁及其化合物的氧化性和还原性,需要在试管中滴加试剂发生反应;
(2)实验探究铁离子的氧化性、亚铁离子的还原性及相互转化;
①在FeCl2溶液中滴入适量氯水,生成氯化铁,Fe元素的化合价升高;
②在FeCl2溶液中加入锌片,由浅绿色变化为无色,铁元素化合价降低生成铁单质;
③在FeCl3溶液中加入足量铁粉,反应生成氯化亚铁,溶液盐酸棕黄色变化为浅绿色,FeCl3中Fe元素的化合价降低;
④证明铁离子具有氧化性,利用铁离子在硫氰酸钾溶液中生成血红色溶液,再加入铜片或铜粉后红色褪去;
(3)元素化合价可以升高也可以降低的既有氧化性,又有还原性;
(4)可加入还原性Fe粉保存亚铁盐.
解答 解:(1)探究铁及其化合物的氧化性和还原性,需要在试管中滴加试剂发生反应,则本实验必不可缺少的一种玻璃仪器是试管,
故答案为:试管;
(2)由实验过程及结论可知,实验目的是探究铁及其化合物的氧化性和还原性,
故答案为:探究铁及其化合物的氧化性和还原性;
①在FeCl2溶液中滴入适量氯水,生成氯化铁,离子反应为:Cl2+2Fe2+=2Cl-+2Fe3+,Fe元素的化合价升高,则Fe2+具有还原性;
②在FeCl2溶液中加入锌片,由浅绿色变化为无色,铁元素化合价降低生成铁单质,Zn+Fe2+=Zn2++Fe,证明亚铁离子具有氧化性;
③在FeCl3溶液中加入足量铁粉,反应生成氯化亚铁,溶液颜色由棕黄色变化为浅绿色,反应的离子方程式为:2Fe3++Fe=3Fe2+,FeCl3中Fe元素的化合价降低,Fe3+具有氧化性;则得到实验结论为Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性,
④证明铁离子具有氧化性,可以利用铁离子在硫氰酸钾溶液中生成血红色溶液,再加入铜片或铜粉后红色褪去,说明铁离子具有氧化性氧化铜为铜离子,本身被还原为亚铁离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
故答案为:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | Cl2+2Fe2+=2Cl-+2Fe3+ | |||
| ② | / | Fe2+具有氧化性 | ||
| ③ | 溶液颜色由棕黄色变化为浅绿色 | |||
| ④ | 在FeCl3溶液中加入硫氰酸钾溶液,然后加足量Cu | / | / |
点评 本题考查性质实验方案的设计,把握发生的氧化还原反应原理及反应中元素的化合价变化为解答的关键,侧重分析能力、实验能力及归纳能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
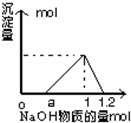 往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )| A. | 1:3 | B. | 1:4 | C. | 1:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
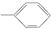 ⑤-CHO.
⑤-CHO.| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中投入Na:Cu2++2Na═Cu+2Na+ | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 用氨水溶解Cu(OH)2:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com