

| A. | A、D所含元素的原子序数大小:A一定比D小 | |
| B. | A、F所含元素的原子半径大小:A一定比F大 | |
| C. | B、E含有化学键类型相同 | |
| D. | 若常温下D为固体,则B可以与NaOH溶液反应 |
分析 A、D、F都是短周期非金属元素单质,A、F所含元素同周期,反应①可为C与二氧化硅的反应,则A为C,D为Si,F为O2,B为SiO2,C为CO,E为CO2,反应①如为C和H2O的反应,A为C,B为H2O,C为CO,D为H2,E为CO2,F为O2,则以此解答该题.
解答 解:由以上分析可知A为C,B为SiO2(或H2O),C为CO,D为Si(或H2),E为CO2,F为O2,
A.如D为H2,则原子半径C>H,故A错误;
B.A为C,F为O2,C和O位于相同周期,原子半径C>O,故B正确;
C.B为SiO2(或H2O),E为CO2,都含有共价键,故C正确;
D.如D为Si,则可与NaOH溶液反应,故D正确.
故选A.
点评 本题考查无机物的推断、常用化学用语等,为高频考点,涉及常见元素及其化合物知识的考查,把握元素的位置及单质的性质来分析推断各物质,注意根据物质的特殊元素、物质结构、物质之间的转化关系进行推断,熟悉常见单质及其化合物的性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 烷烃能使酸性高锰酸钾溶液褪色 | B. | 苯环能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲基使苯环的活性增强 | D. | 苯环使甲基的活性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t(min) | 2 | 4.5 | 5 | 6 |
| X转化率 | 30% | 40% | 70% | 70% |
| A. | 随着反应的进行,混合气体的密度不断增大 | |
| B. | 反应在5.5min时,v正(X)=v逆(Z) | |
| C. | 6min时,容器中剩余1.4mol Y | |
| D. | 其他条件不变,将X的物质的量改为10mol,则可得4mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒压容器中,反应A(s)+2B(g)?2C(g)达平衡后,再通入气体C,平衡不移动,气体B的浓度保持不变 | |
| B. | 恒温恒容容器中,通入一定量的N2O4,反应N2O4?2NO2(g)达平衡后,再通入N2O4,平衡正向移动,再达平衡时N2O4的转化率增大 | |
| C. | 恒温下,向密闭容器中加入NH2COONH4固体,反应NH2COONH4(s)?2NH3(g)+CO2(g)达平衡后,缩小容器的容积,再达平衡时,CO2的浓度不变 | |
| D. | 恒温恒容容器中,N2(g)+3H2(g)?2NH3(g)达平恒后,改变条件使平衡正向移动,再达平衡时NH3的体积分数一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 结论或推测 | |
| A | Na与冷水激烈反应,生成H2 | Mg与沸水迅速反应,生成H2 |
| B | F2与H2暗处剧烈化合,生成的HF很稳定 | I2与H2加热也能化合,生成的HI也很稳定 |
| C | Na与O2加热反应生成Na2O2 | IA元素单质与O2加热反应均生成过氧化物 |
| D | H3PO4是中强酸,As是P的同主族非金属元素 | H3AsO4是强酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
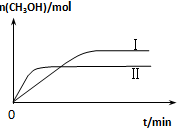 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
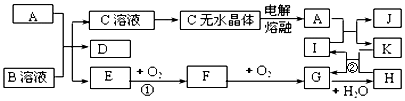
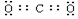 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
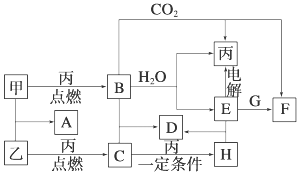
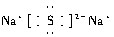 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com