
【题目】下列关于水在人体中的作用错误的是( )
A.提供能量 B.做营养物质水解的反应物 C.做溶剂 D.调节体温
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】制印刷电路时常用氯化铁溶液作为“腐蚀液”。铜被氯化铁溶液腐蚀的方程式为B2FeCl3+Cu![]() 2FeCl2+CuCl2;FeCl3 溶液也能与铁反应2FeCl3+Fe
2FeCl2+CuCl2;FeCl3 溶液也能与铁反应2FeCl3+Fe![]() 3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是
3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是
A.有铜无铁 B.有铁无铜 C.有铁有铜 D.无铁无铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构和性质】 砷的一些化合物常用作半导体、除草剂、杀鼠药等,回答下列问题:
(1)写出基态砷原子的电子排布式_________________;有_________________个未成对电子。
(2)稼氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大到小的顺序是____________;
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为______________,1mol As4O6含有![]() 键的物质的量为____________mol。
键的物质的量为____________mol。

(4)As与N是同族元素,AsH3的沸点比NH3的沸点 ,原因是 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比H3AsO3强的原因是: 。
(6)晶胞有两个基本要素
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子坐标参数A处Li为(0,0,1/2);B处As为(1/4,1/4,1/4);C处Li的坐标参数为 。
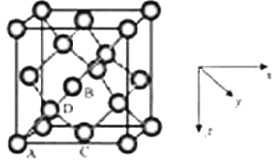
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数,a=594pm,NA表示阿伏伽德罗常数的数值,其密度为 gcm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的来源、结构与性质说法正确的是
A. 甲烷是正四面体结构,性质活泼,常温下能与强酸、强碱发生剧烈反应
B. 乙烯是通过石油裂解得到的,属于不饱和烃
C. 苯与氢气、液溴、浓硝酸的反应类型相同
D. 乙酸又名醋酸,其官能团是醚基,可以与乙醇发生反应生成乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在宇宙飞船和太空站中工作的宇航员,在密闭的工作舱内需要吸入氧气,呼出CO2,飞船内可以使用一种物质,它能吸收CO2,产生氧气,其中主要反应的方程式为_______________。当产生560升氧气(标况)时,反应中转移电子的数目是___________。
(2)在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠(NaClO2),ClO2中氯元索的化合价是__________;在制备亚氯酸钠的反应中ClO2做___________(填“氧化剂”或“还原剂”);若反应中生成1molNaClO2;转移电子物质的量为__________mol。
(3)溶液的导电能力大小主要是由离子浓度大小决定的,利用“液体导电性的实验装置”(如图所示)作下列实验,灯泡能出现:亮一暗一熄灭一亮,现象的是__________。
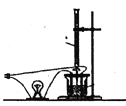
A.向BaCl2溶液中滴入稀H2SO4
B.向Ba(OH)2溶液中滴入稀H2SO4
C.向NaOH溶液中滴入盐酸,写出所选项的离子反应方程式_______________。
(4)己知氯气与热烧碱溶液反应如下:3Cl2+6NaOH=NaClO3+5NaCl+3H2O,
①用双线桥法标出电子转移的方向和数目。
②当有0.1mol电子转移时,参加反应的Cl2在标准状况下的体积_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为1:2的是( )
A.3S+6NaOH=2Na2S+Na2SO3+3H2O
B.2CH3COOH+Ca(ClO)2=2HC1O+Ca(CH3COO)2
C.I2+2NaClO=2NaIO3+C12
D.4HCl(浓)+MnO2![]() MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________反应(填“吸热”或“放热”),且m+n________p(填“>”、“=”或“<”)。
(2)减压使容器体积增大时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若加入B(维持体积不变),则A的转化率____________。
(4)若升高温度,则平衡时B、C的浓度之比将____________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
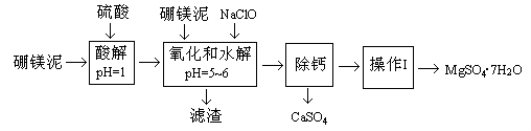
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式 。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精和醋酸是生活里的常用品,下列方法不能将二者鉴别开的是
A. 闻气味 B. 分别用来浸泡水壶中的水垢看是否溶解
C. 分别滴加NAOH溶液 D. 分别滴加石蕊试液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com