
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3- | |
| B. | 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液:H+、Al3+、Cl-、SCN- | |
| D. | 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al能溶于氯化铵溶液中且放出氢气 | |
| B. | Mg条在空气中燃烧可生成三种产物 | |
| C. | MgO是离子化合物,所以工业上用电解其熔融态的方法制取Mg | |
| D. | 向Al2(SO4)3溶液中滴加过量氨水,可得白色沉淀,加入过量NaHSO4溶液沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ③⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与H2S反应的离子方程式:Cu2++S2-=CuS↓ | |
| B. | 硫酸铁溶液与过量浓氨水反应的离子方程式:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| C. | H2、H2S、SO2、CO2四种气体都可用浓硫酸干燥 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
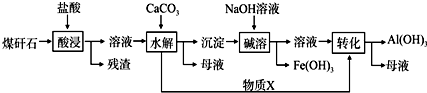
 .该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.
.该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从100mL1.0mol•L-1的NaOH溶液中取出10mL该溶液,其溶液浓度仍为1.0mol•L-1 | |
| B. | 分离酒精和水可以采用分液的方法 | |
| C. | 在蒸发NaCl溶液时,等蒸发至少量液体时,停止加热,利用余热继续蒸干 | |
| D. | 在盛有碘水的试管中加入少量的CCl4后,充分振荡后下层颜色变为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有化学键被破坏的变化不一定是化学变化 | |
| B. | 金属元素与非金属元素原子间形成的化学键不一定是离子键 | |
| C. | 乙炔分子中,σ键与π键数目之比为1:1 | |
| D. | 金刚石中碳原子采取sp3杂化,12g金刚石中含2mol 碳碳单键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com