
����Ŀ���������Ƴ�����Ư����ɱ������������������ˮ�Ͷ�����̼�����ʷ�����Ӧ�����治��ʱ���ױ��ʡ�ijʵ��С���Թ�������Ϊ�о��������������ʵ�顣
(1)̽��һ��Na2O2��Ʒ�Ƿ��Ѿ����ʣ�ȡ������Ʒ�������ܽ⣬����__________��Һ��������а�ɫ������֤��Na2O2�Ѿ����ʡ�
(2)��ʵ��С��Ϊ�˴��Բⶨ�������Ƶ�������������ȡ��m g��Ʒ�����������ͼװ�����ⶨ�������Ƶ�����������

��װ��������a��������_________��װ��D��������________________��
�ڽ��������Ӻ��Ժ�����еĵ�һ��������_____________________��
��д��װ��C�з�����Ҫ��Ӧ�Ļ�ѧ����ʽ_______________________��
�ܷ�Ӧ�������ڶ�ȡʵ����������������ʱ������Ϊ��������________(�����)��
a.��ȡ�������ǰ������ȴ������
b.������ͲʹE��F��Һ��߶���ͬ
c.�����밼Һ�����͵���ƽʱ��ȡ��Ͳ��ˮ�����
�ݶ�����Ͳ��ˮ�������������ɱ�״�������������ΪVmL������Ʒ�й������Ƶ���������Ϊ___________��
���𰸡�BaCl2 ��Һ©�� ���������л��еĶ�����̼���� ���װ�������� 2Na2O2+2CO2=2Na2CO3+O2 abc ![]()
��������
װ��A���Ʊ�������̼��װ��B������ȥ������̼�е��Ȼ��⣬װ��C�й��������������̼��Ӧ������������������������Һ���������еĶ�����̼�����������ˮ������������������ݴ˽��
(1)���������ڿ����б��ʻ��������̼���ƹ��壬̽��һ������������Ʒ�Ƿ��Ѿ����ʣ���������̼������Ӻͱ����ӽ������̼�ᱵ��ɫ����֤��Na2O2�Ѿ����ʣ��ʴ�Ϊ��BaCl2��
(2)��װ��������a�������ǣ���Һ©����װ��D�������ǣ����������л��еĶ�����̼���壬�ʴ�Ϊ����Һ©�������������л��еĶ�����̼���壻
��ʵ��̽���ⶨ�����Dzⶨ������̼�������Ʒ�Ӧ���ɵ�������װ���б�������������ã����������Ӻ��Ժ�����еĵ�һ�������Ǽ��װ�õ������ԣ��ʴ�Ϊ�����װ�õ������ԣ�
��װ��C���Ƕ�����̼�������Ʒ�Ӧ����̼���ƺ������ķ�Ӧ,��Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2CO2��2Na2CO3+O2��
��a.ֱ�Ӷ�ȡ�������������ȴ�����£���ʹ��Һ��������������������a��ȷ��
b.������Ͳ����Һ��߶�ʹ֮��ͬ��ʹװ����ѹǿ�����ѹǿ��ͬ�������ȡ�����������b��ȷ��
c.�����밼Һ�����͵���ƽ��ȡ��Ͳ��ˮ���������ȷ�Ķ�ȡ��������c��ȷ��
�ʴ�Ϊ��abc��
�ݲⶨ����Ͳ��ˮ�������,����ɱ�״�������������ΪVmL�����ʵ���=![]() ,����Ʒ�й������Ƶ���������Ϊ=
,����Ʒ�й������Ƶ���������Ϊ=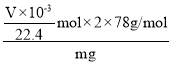 ��100%=
��100%=![]() %��
%��


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������E��һ��ҽҩ�м��壬�������Ʊ�����Ѫҩ������ͨ����ͼ��ʾ��·�ߺϳɣ�
(1)�л���A�ṹ��ʽΪ___________��B������Ϊ___________��
(2)Cת��ΪD�ķ�Ӧ������___________��
(3)д��E������NaOH��Һ��ȫ��Ӧ�Ļ�ѧ����ʽ___________
(4)1moD��ȫˮ�����ữ�������л��������� NaHCO3��Һ��Ӧ����CO2���ʵ���Ϊ___________��
(5)д��ͬʱ��������������C��ͬ���칹��Ľṹ��ʽ___________��
�ٱ�����ֻ������ȡ�������ҳ���������������״�ṹ
�ں˴Ź�������ֻ��5����
������FeCl3��Һ������ɫ��Ӧ
����ˮ�Ⲣ����������Һ��Ӧ
(6)��֪�����ǻ�һ�㲻��ֱ���������������ױ��ɱ����Ը��������Һ����Ϊ�����ᡣ�Բ��������ϳ�·��ͼ��д���Ա��ӡ��ױ�Ϊԭ����ȡ�����ᱽ��(![]() )�ĺϳ�·��(��ԭ����ѡ)___________��
)�ĺϳ�·��(��ԭ����ѡ)___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�������ӡ����ӡ����ӵ������������͵���֮�����һ�������ϵ������д���пհף�
(1)����������________�����ࣻ������������������________�����ࡣ
(2)![]() ����һ��������Ϊ________��������Ϊ______��������Ϊ________�����������Ϊ________��ԭ�ӡ�
����һ��������Ϊ________��������Ϊ______��������Ϊ________�����������Ϊ________��ԭ�ӡ�
(3)��������________��________������һԭ�ӣ��˵������________��������ԭ�ӣ������������________��
(4)ZXn���к����������________��ZXn���к��������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͳ��ҩ������׳�����˪������ش��������⣺
(1)����ķ��ӽṹ��ͼ����ʾ���û�������Asԭ�ӵ��ӻ���ʽΪ__��
(2)��̬��ԭ�ӵļ۲�����Ų�ʽΪ__���������ĵ�һ�����ܽϴ����__��
(3)��֪��

���ݱ������ݽ���NH3�۵���ߵ�ԭ��__��
(4)����(H3AsO4)��һ����Ԫ��ǿ�ᣬ���ݼ۲���ӶԻ��������Ʋ�AsO43���Ŀռ乹��Ϊ__��
(5)�����Ͻ�ľ�����ͼ����ʾ���þ�������ÿ��Niԭ�Ӿ��������Asԭ����__����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���J��һ��������ʹҩ����ͼΪJ�ĺϳ�·��(���ֲ���ͷ�Ӧ����ʡ��)��

��֪������Ϣ���£�
��![]() (������������ˮ����ȷ�Ӧ)
(������������ˮ����ȷ�Ӧ)
��![]()
�ش��������⣺
(1)A�й����ŵ�������_________��D + I��J�ķ�Ӧ����Ϊ___________��
(2)��ӦB��C�Ļ�ѧ����ʽΪ__________________��
(3)E��F�ķ�Ӧ����Ϊ___________������������E������ʺɱ�Ϊ________��
(4)J�ж���ͬ���칹�壬�������������������ұ�����һ�ȴ���ֻ�����ֵ��칹��Ľṹ��ʽΪ________________��
a.����(�CNH2)�뱽��ֱ��������b.�ܷ���������Ӧ��c.�ܷ���ˮ�ⷴӦ
(5)֤��G�Ѳ�������H��ʵ�鷽����__________________��
(6)�����������̣������ 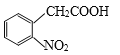 Ϊԭ�ϣ��Ʊ�
Ϊԭ�ϣ��Ʊ� �ĺϳ�·��(���Լ���ѡ)��_______________________________��
�ĺϳ�·��(���Լ���ѡ)��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pAg����lg{c(Ag��)}��Ksp(AgCl)��1.56��10��10����ͼ����10 mL AgNO3��Һ������0.1 mol��L��1��NaCl��Һʱ����Һ��pAg���ż���NaCl��Һ�����(��λmL)�仯��ͼ��(ʵ��)������ͼ���������н�����ȷ����[��ʾ��Ksp(AgCl)>Ksp(AgI)]

A. ԭAgNO3��Һ�����ʵ���Ũ��Ϊ0.1 mol��L��1
B. ͼ��x�������Ϊ(100,6)
C. ͼ��x���ʾ��Һ��Ag��ǡ����ȫ����
D. ��0.1 mol��L��1��NaCl����0.1 mol��L��1NaI��ͼ�����յ���Ϊ���߲���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���CO2ͨ��2LpH=12��KOH��Һ�У���Һ��ˮ�����OH-����Ũ��(��)��ͨ���CO2�����(V)�Ĺ�ϵ����ͼ��ʾ��������������ȷ����

A��a����Һ�У�ˮ�������c(H+)=1��10-12mol/L
B��b����Һ�У�c(H+)=1��10-7mol/L
C��c����Һ�У�c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D��d����Һ�У�c(K+)=2c(CO32-)+c(HCO3-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£�Ksp(Ag2SO4)��2.0��10��5��ȡ����Ag2SO4��������ˮ�õ�200 mL������Һ���ڸñ�����Һ��c(SO42-)��0.017 mol��L��1����ñ�����Һ�м���0.020 mol��L��1 Na2SO4��Һ200 mL���õ���ҺR��(�����ǻ�Ϻ���Һ����ı仯)����˵����ȷ����( )
A.R��c(Ag��)��2c(SO42-)
B.�õ���ҺR�Ĺ����л��������
C.R��c(Ag��)��0.017 mol��L��1
D.����Na2SO4��Һ�ٽ������ܽ�ƽ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ����һ�����Ϳ��ס����ȡ���ʹҩ����ṹ������ʾ�����жԸû�����������ȷ����

A. ��ŵ������ʽΪ![]()
B. ��ŵ�����ڷ�����
C. ��ŵ�����ڸ߷��ӻ�����
D. ��֪��ŵ����ˮ�����֮һΪ���������ӣ� �����ں˴Ź��������У�������������5�ַ�
�����ں˴Ź��������У�������������5�ַ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com