
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 | B. | 0.25mol•L-1 | C. | 0.45mol•L-1 | D. | 0.225mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
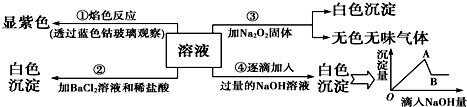
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| B. | 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 | |
| C. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| D. | 二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 小苏打溶液中加入烧碱溶液:HCO3-+OH-═H2O+C02↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | 向氯化亚铁溶液中加入氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式:Ag+Cl--e-=AgCl | |
| B. | 电子从电源的正极经外电路流向负极 | |
| C. | Cl-不断向“海水”电池的负极移动 | |
| D. | 每生成1molNa2Mn5O10转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com