
| m |
| M |
| n |
| v |
| 2.33g |
| 233g/mol |
| n |
| v |
| 0.04mol |
| 0.1L |


科目:高中化学 来源: 题型:
 图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,打开K,接通电路后,发现B 上的 C 点显红色,请填空:
图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,打开K,接通电路后,发现B 上的 C 点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25 | B、30 | C、55 | D、80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯原子的结构示意图: | ||||||||
B、用电子式表示氯化氢分子的形成过程:H?:
| ||||||||
C、氯化镁的电子式: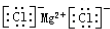 | ||||||||
| D、甲烷的结构式:CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的最简式为CH2O |
| B、A可以发生氧化反应,不能发生还原反应 |
| C、A的同分异构体中可能含有二元醛 |
| D、若A为羟基酸时,能生成六元或八元环状内酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ.mol-1,N2(g)+O2(g)=2NO(g)△H=+180kJ.mol-1, 则2CO(g)+2NO(g)=N2(g)+2CO2(g);△H=-746kJ/mol | ||
B、由CH3(CH2)2CH3(g)+
| ||
| C、OH(aq)-+H(aq)+=H2O(l)△H=-57.3kJ.mol-1故1mol醋酸与1molOH完全反应,放出的热量一定为57.3kJ | ||
| D、已知P4(白磷,s)=4P(红磷,s)△H<0,则白磷比红磷稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com