
下列溶液显酸性的是
| A.NaCl溶液 | B.Na2CO3溶液 | C.AlCl3溶液 | D.KNO3溶液 |
科目:高中化学 来源: 题型:单选题
某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
| A.Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线 |
| B.b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同 |
| C.a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同 |
| D.c点溶液的导电能力一定比b点溶液导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
0.1 mol/L K2CO3溶液中,若要使c(CO32-)更接近0.1 mol/L,可采取的措施是
| A.加入少量盐酸 | B.加KOH固体 | C.加水 | D.加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到
滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是:
A.浊液a中存在沉淀溶解平衡:AgCl(g) 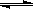 Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将标准状况下1.12L氨气溶于500mL水中配制成溶液,从中取出5mL,有关这5mL溶液的叙 述正确的是
| A.溶液中c(NH4+)< c(OH—) | B.氨水的物质的量浓度为0.1 mol·L—1 |
| C.溶液的pH>13 | D.与5mL 0.1mol·L—1HCl溶液恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01 mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
在下列试剂中沉淀效果最好的是( )
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验原理、方法和结论都正确的是( )
| A.用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质 |
| B.在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
| C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大 |
| D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )。
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)=c(HCO3—) |
| C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是 ( )。
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+ c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 mL |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32—)=c(HCO3—)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com