

| A、该硫酸的物质的量浓度为9.2mol/L |
| B、1molZn与足量的该硫酸反应产生2g氢气 |
| C、配制200mL4.6mol/L的稀硫酸需取该硫酸500mL |
| D、该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2mol/L |
| 103ρω |
| M |
| 103ρω |
| M |
| 103×1.84×98% |
| 98 |
| 4.6mol/L×0.2L |
| 18.4mol/L |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、推广“低碳经济”,减少温室气体的排放 |
| B、利用品体硅制作的太阳能电池将太阳能直接转化为电能 |
| C、采用催化设施,将汽车尾气中CO和NO转化为无害气体 |
| D、推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、CO的燃烧热为283kJ |
B、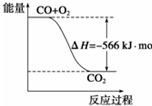 可表示有CO生成CO2的反应过程和能量关系 |
| C、Na2O2(s)+2CO2═Na2Co3(s)+O2(g)△H>-532kJ?mol-1 |
| D、CO(g)与Na2O2(s)反应放出549kJ热量时,电子转移数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、CO32-、Ag+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、NO3-、Na+、MnO4-、K+ |
| D、Ca2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
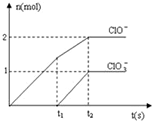 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、ClO
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、ClO- 3 |
- 3 |
| A、0~t1时,Ca(OH)2与Cl2发生反应的总化学方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O | ||
B、t2时,Cl-与ClO
| ||
| C、该石灰乳中含有Ca(OH)2的物质的量为10mol | ||
| D、由图可知,生成Ca(ClO3)2的反应是由温度升高引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、CO的燃烧热为283 kJ |
B、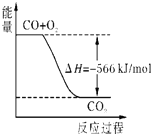 如图可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为1.204×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①=④>③=② |
| B、④=①>③>② |
| C、①>④>③>② |
| D、④>①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.4 mL |
| B、5.6 mL |
| C、4.2 mL |
| D、2.8 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com