
| A. | 14.4 g | B. | 11.6 g | C. | 8.8 g | D. | 3.2 g |
分析 Fe和稀HNO3反应生成NO,n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子的物质的量=0.1mol×(5-2)=0.3mol,当Fe完全转化为亚铁离子时需要铁的量最多,根据转移电子守恒计算溶解铁的质量,根据需要铁的质量和已知铁的质量对比得出铁是否完全溶解,从而计算剩余铁的质量.
解答 解:Fe和稀HNO3反应生成NO,n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子的物质的量=0.1mol×(5-2)=0.3mol,当Fe完全转化为亚铁离子时需要铁的量最多,根据转移电子守恒得溶解m(Fe)=$\frac{0.3mol}{2}$×56g/mol=8.4g,所以铁有剩余,剩余铁的质量=20g-8.4g=11.6g,
故选B.
点评 本题考查了物质的量的有关计算,明确铁转化为亚铁离子需要铁的质量最多是解本题关键,再根据转移电子守恒判断铁是否完全溶解,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  利用甘油密度大于乙醇且更易溶于水,进行甘油与乙醇的混合物分离 | |
| B. | 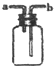 进行H2,NH3,CO2,Cl2,HCl,NO2等气体收集,也能用于NO气体收集 | |
| C. |  当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 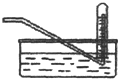 常用于实验室收集氧气、氢气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA | |
| C. | 46g乙醇中含有C-H键的数目为6NA | |
| D. | 常温下,2.7g金属铝与足量浓度为18mol/L的浓硫酸反应时转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
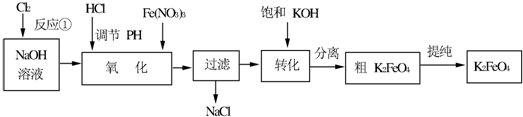

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
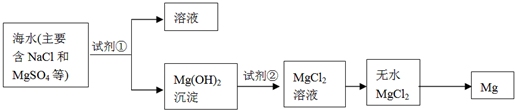


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com