
| A. | C4H8 | B. | C2H6O | C. | C3H6O | D. | C2H4O2 |
分析 根据分子式计算不饱和度,判断侧链是否含有不饱和键,根据H原子数目之比,可知三种H原子数目分别为6、1、1,故分子中含有2个-CH3(或-OCH3),且两个甲基(或-OCH3)相同,分子中另外2个H原子不同,分子中的Cl原子皆形成C-Cl键,2个Cl原子连接苯环上,据此书写可能的结构,进行判断.
解答 解:芳香化合物的分子式为C8H8Cl2O2,分子中含有1个苯环,不饱和度为$\frac{18-8-2}{2}$=4,故侧链不含不饱和键,其分子结构中有三种不同化学环境的氢,它们的数目之比为6:1:1,故三种H原子数目分别为6、1、1,故分子中含有2个-CH3(或-OCH3),且两个甲基(或-OCH3)相同,分子中另外2个H原子不同,分子中的Cl原子皆形成C-Cl键,2个Cl原子连接苯环上,不考虑O与O相连接,符合条件的可能结构有: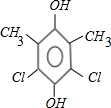 、
、 ,故有2种结构,
,故有2种结构,
A、C4H8可以为1-丁烯、2-丁烯、2-甲基-1-丙烯、环丁烷等,多余2个,故A错误;
B、C2H6O可以为乙醇或甲醚,只有2种结构,故B正确;
C、C3H6O可以为丙醛、丙烯醇、环氧丙烷等,多余2种,故C错误;
D、C2H4O2可以为乙酸、甲酸甲酯、羟基乙醛等,多余2种,故D错误,故选B.
点评 本题主要考查限制条件同分异构体的书写和判断,难度较大,判断分子中含有2个-CH3是关键.


科目:高中化学 来源: 题型:解答题
| 元素 | T | X | Y | Z |
| 信息 | 原子最外层电子数比内层电子数多4 | 最高正价为+5,单质性质很稳定 | L层电子数比其他电子层电子数之和多5 | 单质、最高价氧化物(R)及对应的水化物均可与Y的最高价氧化物对应的水化物(M)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,能发生取代、氧化、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与4 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
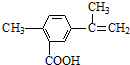
| A. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol•L-1 | |
| B. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| C. | SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在 | |
| D. | 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 体积 | 起始物质 | 平衡时C的物质的量 | 平衡时B的体积分数 | 平衡常数 |
| 甲 | 1L | 1molA+2molB | 1mol | φ甲 | K甲 |
| 乙 | 1L | 4molC+2molD | n1 mol | φ乙 | K乙 |
| 丙 | 2L | 4molC+2molD | n2 mol | φ丙 | K丙 |
| A. | 在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大 | |
| B. | K甲=K丙>K乙 | |
| C. | 升高甲的温度,可使φ甲=φ乙 | |
| D. | n1=1.6,n2=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.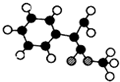
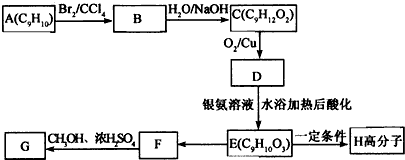
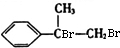 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$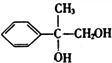 +2NaBr
+2NaBr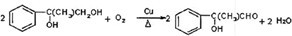
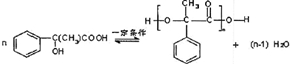
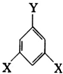 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式: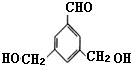 、
、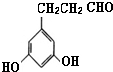 、
、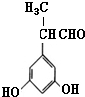 、
、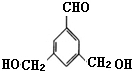 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.1 mol•L-1的AlCl3溶液 | B. | 20mL0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30mL0.2 mol•L-1的KCl溶液 | D. | 100mL0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
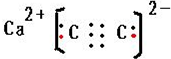 ;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).
;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com