
Ⅰ.制备水杨酸对正辛基苯基酯(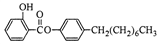 )的过程如下:
)的过程如下:
步骤一:将水杨酸晶体投入到三颈烧瓶中,再加入适量的氯苯作溶剂并充分搅拌使晶体完全溶解,最后加入少量的无水三氯化铝。
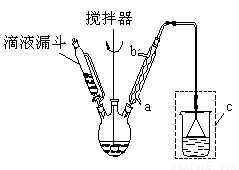
步骤二:按下图所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯。
该反应方程式为:
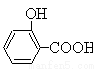 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→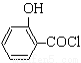 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中混合液升温至80℃,再加入对正辛苯酚[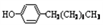 ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥即得产品。
(1)实验时,冷凝管中的冷却水进口为 _______(选填“a”或“b”);
(2)步骤一中加入无水三氯化铝的作用是 ___________________________。
(3)步骤三中发生反应的化学方程式为 _____________________________。
Ⅱ.PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
白磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
已知下图是实验室制备PCl3的装置(部分仪器已省略),则:
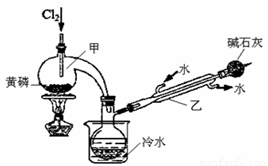
(1)实验室制备Cl2的离子反应方程式为:________________。
(2)碱石灰的作用除了防止空气中的O2和水蒸气进入并与产品发生反应外还有:_________。
(3)向仪器甲中通入干燥Cl2之前,应先通入一段时间的干燥CO2,其目的是_____________。
(4)测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。已知:H3PO3+H2O+I2==H3PO4+2HI;I2+2Na2S2O3==2NaI+Na2S4O6;假设测定过程中没有其他反应,则根据上述数据,求出该产品中PCl3的质量分数为 ___________________(用含字母的代数式表示、可不化简)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届河北省高三上期末化学试卷(解析版) 题型:选择题
某元素最高价氧化物对应的水化物的化学式为H2XO3,该元素的气态氢化物的化学式是( )
A. XH4 B. H2X C. XH3 D. HX
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二上学期期末考试化学试卷(解析版) 题型:选择题
对于溶液中的反应:MnO +5Fe2++8H+===5Fe3++Mn2++4H2O,下列措施能使化学反应速率提高的是( )
+5Fe2++8H+===5Fe3++Mn2++4H2O,下列措施能使化学反应速率提高的是( )
A. 加水
B. 增加同浓度FeSO4的用量
C. 向溶液中滴加稀硫酸
D. 加入少量KMnO4晶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
将3.20g Cu跟50.0mL l0.0mol/L的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有xmolH+,则此时溶液中合NO3-的物质的量为( )
A. xmol B. (x+0.1) mol C. 2xmol D. 0.1xmol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
如图是产生和收集气体的实验装置,该装置适合于( )
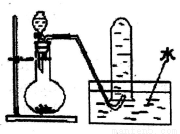
A. 用浓硝酸与Cu反应制取NO2 B. 用浓盐酸和MnO2反应制取Cl2
C. 用H2O2溶液和MnO2反应制取O2 D. 用NH4Cl和Ca (OH)2反应制取NH3
查看答案和解析>>
科目:高中化学 来源:江西省新余市、宜春中学2017届高三下学期开学联考理科综合-化学试卷 题型:选择题
以铅蓄电池为电源,石墨为电极电解CuSO4溶液,装置如图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是 ( )
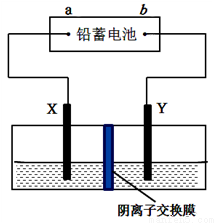
A. a为铅蓄电池的负极 B. 电解过程中SO42-向右侧移动
C. 电解结束时,左侧溶液质量增重8g D. 铅蓄电池工作时正极电极反应式为:PbSO4+2e-=Pb+SO42-
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三12月月考化学卷(解析版) 题型:实验题
为回收利用废钒催化剂(含有V205、V0S04及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
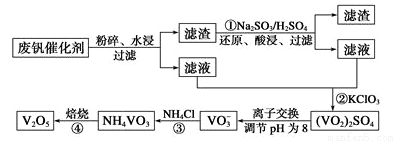
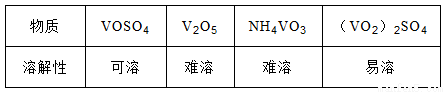
部分含钒物质常温时在水中的溶解性如下:
回答下列问题:
(1)废钒催化剂,粉碎的目的是 ,V0S04溶液水解显酸性,离子方程式为
(2)工业上由 V2O5冶炼金属钒常用铝热法,该反应的化学方程式为 引发铝热反应的操作是:在纸漏斗中加入铝热剂后,再
V2O5冶炼金属钒常用铝热法,该反应的化学方程式为 引发铝热反应的操作是:在纸漏斗中加入铝热剂后,再
(3)为了提高钒的浸出率,反应①用Na2SO3和硫酸酸浸使催化剂中的V2O5转变成可溶于水的V0S04,与水浸液合并,再通过反应②用KClO3氧化,使+4价的V氧化成易溶于水的(VO2)2SO4反应①的离子方程式为
(4)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为 。
(5)已知常温下NH4VO3的溶解度为0.468g/100g水,则NH4VO3的溶度积常数约为 (已知V的相对原子质量为51)。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:选择题
下列实验中,对应的现象以及结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向氯水中加入过量的铁粉,充分反应后滴加酸性高锰酸钾溶液 | 有气体生成,高锰酸钾溶液褪色 | 氯水将Fe氧化为Fe2+ |
B | 向某钾盐中滴加浓盐酸,产生气体再通入品红溶液 | 品红溶液褪色 | 该钾盐为K2SO3或KHSO3 |
C | 向1.0 mol·L-1的NaHCO3溶液中滴加2滴甲基橙 |
| NaHCO3溶液呈碱性 |
D | 向浓度均为0.1 mol·L-1的Al2(SO4)3、Fe2(SO4)3的溶液中逐滴加入氨水 | 先有红褐色沉淀生成,后有白色沉淀生成 | Al(OH)3的溶度积比Fe(OH)3的大 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:简答题
低浓度SO2废气的处理是工业难题,工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
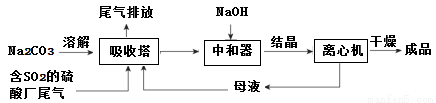
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合
理措施______________、_______________。(写出两条)
(2)中和器中发生的主要反应的离子方程式是_____________________。
(3)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。

①则初期反应(图中A点以前)的化学方程式是__________________。
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如下:
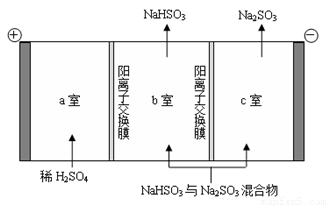
简述分离NaHSO3与Na2SO3混合物的原理___________________。
(4)下图是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是______

A.a点时溶液为不饱和溶液
B.b点时Na2SO3·7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是__________
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com