
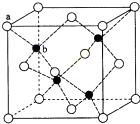
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
| ||
| V |
| 2 |
| 6+2 |
| 2 |
 ,
, ;
;| 1 |
| 8 |
| 1 |
| 2 |
| ||
| V |
| ||
| (540×10-10cm)3 |
| 2 |
| 2 |
|
| 270 | ||
|
| 270 | ||
|


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
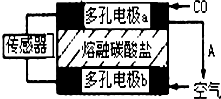
| A、通CO的一极是电池的正极 |
| B、该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C、负极反应式:O2+2CO2+4e-═2CO32- |
| D、该电池工作过程中有蓝色火焰产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 |
| B、苯和浓硝酸、浓硫酸混合物在100-110℃才能生成二硝基苯,而甲苯在100℃时即可生成三硝基甲苯,说明甲基对苯环产生了影响 |
| C、甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤 |
| D、除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O
| ||
B、苯酚钠溶液中通入少量CO2: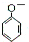 +H2O+CO2→ +H2O+CO2→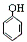 +HCO3- +HCO3- | ||
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-═NH3?H2O+H2O | ||
| D、氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.
2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.| 催化剂 |
| 浓度 时间/s |
0 | 1 | 2 | 3 | 4 | 5 | 6 |
| c(NO)(×10-4mol/L) | 8.50 | 4.50 | a | 1.50 | 1.00 | 0.80 | 0.80 |
| c(CO)(×10-3mol/L) | 3.60 | 3.20 | 3.00 | b | 2.85 | 2.83 | 2.83 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
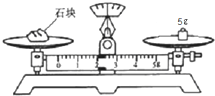 实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com