
| 步骤 | 实验操作 | 实验现象及数据 |
| ① | 取wgM粉末溶于过量的盐酸 | 产生气体X在标准状况下的体积为224mL,并得到无色溶液 |
| ② | 向步骤①所得的溶液中滴加氨水,调节pH至6,过滤、洗涤、灼烧、称重 | 固体Y的质量为1.020g |
| ③ | 向步骤②所得的滤液中滴加氢氧化钠溶液,调节pH至12,过滤、洗涤、灼烧、称重 | 固体Z的质量为1.200g |
分析 (1)根据步骤②、③中固体质量的精确度判断称量仪器;
(2)根据化合物呈现电中性,即阳离子所带的正电荷等于阴离子所带的负电荷,确定M中a、b、c、d之间定量关系;
(3)wgM中,n(CO32-)=n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,n(Al3+)=2n(Al2O3)=2×$\frac{1.020g}{102g/mol}$=0.02mol,n(Mg2+)=n(MgO)=$\frac{1.200g}{40g/mol}$=0.03mol,根据电荷守恒可得到M中a、b、c、d之间定量关系;
(4)Mg3Al2(OH)10CO3中的OH-、CO32-与盐酸溶液中的H+发生离子反应;
(5)由(3)中计算可知,wg抗酸药中含有Mg3Al2(OH)10CO3的物质的量为0.01mol,质量m=0.01mol×356g/mol=3.65g,则ω=$\frac{3.65g}{wg}$×100%.
解答 解:(1)根据步骤②固体Y的质量为1.020g,步骤③固体Z的质量为1.200g,精确度为0.001g,因此称量固体,应选择的称量仪器是电子天平,
故答案为:电子天平;
(2)根据化合物呈现电中性,即阳离子所带的正电荷等于阴离子所带的负电荷,2×a+3×b=1×c+2×d,即为2a+3b=c+2d,
故答案为:2a+3b=c+2d;
(3)步骤①气体X为CO2,步骤②中Y为Al2O3,步骤③中Z为MgO,在wgM中,根据原子守恒,
n(CO32-)=n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,n(Al3+)=2n(Al2O3)=2×$\frac{1.020g}{102g/mol}$=0.02mol,n(Mg2+)=n(MgO)=$\frac{1.200g}{40g/mol}$=0.03mol,
则a:b:d=0.03mol:0.02mol:0.01mol=3:2:1,
若a=3、b=2、d=1,由2a+3b=c+2d可知,c=10,
因此M的化学式为Mg3Al2(OH)10CO3,
故答案为:Mg3Al2(OH)10CO3;
(4)Mg3Al2(OH)10CO3中的OH-、CO32-与盐酸溶液中的H+发生离子反应,离子方程式为10OH-+CO32-+12H+=CO2↑+11H2O,
故答案为:10OH-+CO32-+12H+=CO2↑+11H2O;
(5)wgM中,n(CO32-)=0.01mol,n(Al3+)=0.02mol,n(Mg2+)=0.03mol,wg抗酸药中含有Mg3Al2(OH)10CO3的物质的量为0.01mol,质量m=0.01mol×356g/mol=3.65g,则ω=$\frac{3.65g}{wg}$×100%=$\frac{365}{w}$%,
故答案为:$\frac{365}{w}$%.
点评 本题考查了复杂化学式的推断,为高频考点,熟知元素及其化合物的性质是答题关键,涉及的离子反应及其计算是难点,整体难度较大.


科目:高中化学 来源: 题型:选择题
| 阳极 | 阴极 | 溶液甲 | 物质乙 | |
| A | Pt | Pt | CuCl2 | CuCl2固体 |
| B | Pt | Pt | H2SO4 | H2O |
| C | Pt | Pt | NaCl | 盐酸 |
| D | Pt | Pt | CuSO4 | CuO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
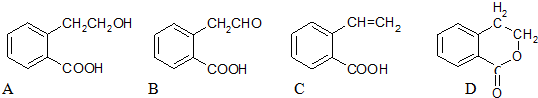

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在NO2中的NO:将气体与足量O2混合 | |
| B. | 除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:加入金属钠后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
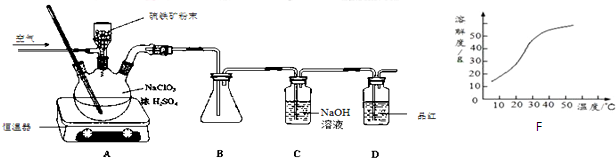
 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
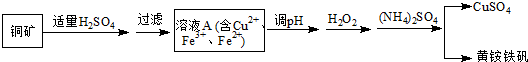
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 评价 |
| A | 将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
| B | 用Cu作电极电解NaCl溶液,阳极的电极反应式: 2Cl--2e-═Cl2↑ | 正确; Cl-优先于OH-放电 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-═HClO+HSO | 正确; H2SO3的酸性强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2-+2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | 正确; Mg(OH)2比MgCO3更难溶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | amol | B. | bmol | C. | (3a-b)mol | D. | (a+b)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com