
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
【答案】C
【解析】
A.3p能级有一个空轨道的基态原子,该原子3p能级有2个电子,核外电子排布式为1s22s22p63s23p2,二者核外电子排布相同,为同一原子,故A不选;
B.2p能级无空轨道,有一个未成对电子的基态原子,该原子2p能级有5个电子,价电子排布为2s22p5的原子,为同一原子,故B不选;
C.M层全充满而N层为4s2的原子的核外电子排布为1s22s22p63s23p63d104s2,二者原子核外电子排布不相同,不是同一原子,故C选;
D.最外层电子数是核外电子总数的![]() 的原子中,最外层电子数要小于或等于8个电子,且电子总数为5的倍数,所以可得该原子可能是原子序数为5、10、15、20、25、30、35、40,其中满足最外层电子数是核外电子总数的1/5且符合核外电子排布规则的只能是35号元素,该元素原子的外围电子排布式为4s24p5,所以两原子是同种元素的原子,故D不选;
的原子中,最外层电子数要小于或等于8个电子,且电子总数为5的倍数,所以可得该原子可能是原子序数为5、10、15、20、25、30、35、40,其中满足最外层电子数是核外电子总数的1/5且符合核外电子排布规则的只能是35号元素,该元素原子的外围电子排布式为4s24p5,所以两原子是同种元素的原子,故D不选;
故选C。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
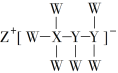
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下图所示。下列说法中,错误的是
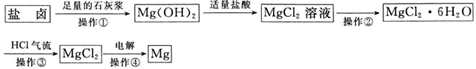
A.操作①发生的反应为非氧化还原反应
B.在实验室进行操作①时,只需要漏斗和烧杯两种玻璃仪器
C.操作②是蒸发浓缩、冷却结晶
D.在整个制备过程中未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
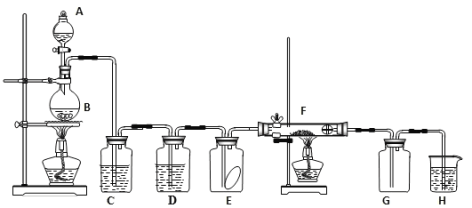
(1)装置C中盛装的溶液是____________,D中试剂的作用是____________________。
(2)E中的红色布条是否褪色?____(填“是”或“否”),写出F中反应的化学反应方程式:____________________,其反应现象为__________________________。
(3)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为_________________________。
(4)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的合成中间体,其合成路线如图所示:
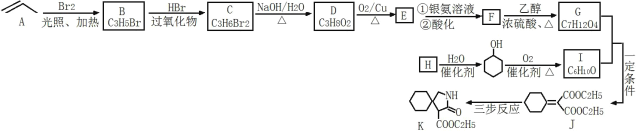
已知:HBr与不对称烯烃加成时,在过氧化物作用下,则卤原子连接到含氢较多的双键碳上;
请回答下列问题:
(1)C的化学名称为____,J中官能团的名称是____;
(2)H→![]() 的原子利用率为100%,则H的结构简式为____;
的原子利用率为100%,则H的结构简式为____;
(3)C→D的化学方程式为____;
(4)E与足量的Ag(NH3)2OH溶液反应的化学方程式为____;
(5)L是G的同分异构体,则满足下列条件的L的结构简式为____(任写一种结构即可)。
①lmol L与足量的NaHCO3溶液反应能生成2molCO2;
②L的核磁共振氢谱有3组峰且峰面积之比为1︰2︰3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和1H核磁共振谱如下图所示,下列说法中错误的是( )
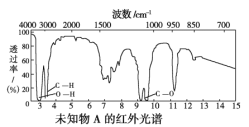
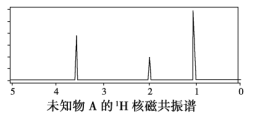
A. 由红外光谱图可知,该有机物中至少含有三种不同的化学键
B. 由1H核磁共振谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C. 若A的化学式为C2H6O,则其结构简式为CH3CH2OH
D. 仅由其1H核磁共振谱就可得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
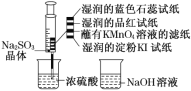
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有KMnO4溶液的滤纸均褪色都能证明SO2的漂白性
C.湿润的淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li2O是离子晶体,从如图的BornHaber循环可得出Li2O晶格能为 ( )
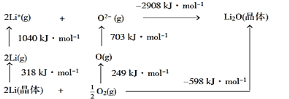
A. 598kJ·mol1B. -598KJ·mol1C. 1168kJ·mol1D. 2908kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是( )
A.升高温度,该反应的平衡常数减小
B.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
C.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D.第二阶段,Ni(CO)4分解率较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com