
| A. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H(中和热) | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H(中和热) | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H (燃烧热) | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H(燃烧热) |
分析 中和热是强酸和强碱的稀溶液完全反应生成1mol水时放出的热量,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,标注物质聚集状态得到热化学方程式,依据概念对选项分析判断.
解答 解:A、选项热化学方程式生成了2mol水,并且反应产生沉淀,硫酸钡沉淀的生成也伴随有沉淀热的变化,所以反应的焓变不是反应热,故A错误;
B、反应过程中浓硫酸溶于水的过程是放热的,所以反应的焓变不是反应热,故B错误;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,不能是燃烧2mol氢气,故C错误;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量该反应的焓变符合燃烧热的概念,故D正确;
故选D.
点评 本题考查了中和热、燃烧热的概念分析判断,准确理解概念是解题关键.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:推断题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
 .
. .
. ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
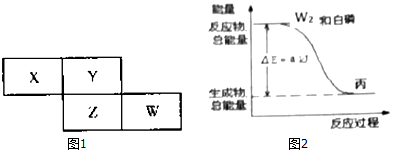
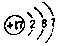 .
.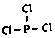 .白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.
.白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.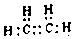 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-的质量是17g/mol | |
| B. | CO2的摩尔质量是44 | |
| C. | 标况下气体的摩尔体积是22.4L | |
| D. | 12gC-12中含的C原子数是阿伏伽德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取溴水中溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 溶解固体时烧杯在使用前必须干燥 | |
| C. | 萃取、分液前需对分液漏斗检漏,分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸馏操作时,不可以用温度计搅拌,温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
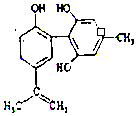
| A. | 标准状况下,22.4L HF中含有氟原子数目为NA | |
| B. | 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) | |
| C. | 1mol 如图物质与浓溴水反应时通常最多消耗Br2为6mol | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
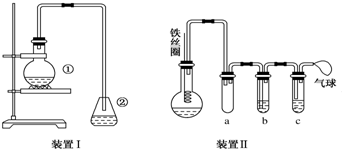
 .②中离子方程式为Br-+Ag+═AgBr↓.
.②中离子方程式为Br-+Ag+═AgBr↓. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com