
某溶液只含有Na+,Al3+,Cl﹣,SO42﹣四种离子,已知Na+,Al3+,Cl﹣的个数比为3:2:1.则溶液中Al3+与SO42﹣离子的个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
考点: 物质的量的相关计算.
分析: 令Na+、Al3+、Cl﹣的物质的量分别为3mol、2mol、1mol,根据溶液中电荷守恒有n(Na+)+3n(Al3+)=n(Cl﹣)+2n(SO42﹣),据此计算SO42﹣的物质的量,离子数目之比等于二物质的量之比.
解答: 解:令Na+、Al3+、Cl﹣的物质的量分别为3mol、2mol、1mol,
根据电荷守恒有n(Na+)+3n(Al3+)=n(Cl﹣)+2n(SO42﹣),
即3mol+2×3mol=1mol+2n(SO42﹣),
解得n(SO42﹣)=4mol,
则溶液中Al3+和SO42﹣离子的个数比为2mol:4mol=1:2,
故选A.
点评: 本题考查物质的量浓度的有关计算,难度中等,注意电解质的混合溶液中离子浓度的计算,经常利用电荷守恒计算.


科目:高中化学 来源: 题型:
下列叙述或操作不正确的是( )
|
| A. | 浓硫酸具有强氧化性,稀硫酸无氧化性 |
|
| B. | 浓硫酸不慎沾到皮肤上,立即用大量的水冲洗 |
|
| C. | 稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌 |
|
| D. | 浓硫酸与碳的反应中,浓硫酸仅表现强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ实验室进行实验①制乙烯②制溴苯③石油分馏④银镜反应
(1)不需要加热的有 ;
(2)需要水浴的有 ;
(3)需要加碎瓷片的有 ;
(4)反应中必须加入浓H2SO4的有 ;(填序号)
Ⅱ现有:A.(CH3)3CCl;B.(CH3)3CCH2Cl;C.(CH3)2CHCl;D.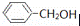 四种有机物
四种有机物
(1)能水解生成醇的是 ;(填字母)
(2)不能消去成烯的是 ;(填字母)
(3)D与甲酸发生酯化反应的产物是 .(写分子式)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是( )
A. C+HNO3 B. SO2+HNO3 C. Fe(OH)3+HNO3 D. FeO+HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A. 石灰石溶于盐酸:CO32﹣+2H+═H2O+CO2↑
B. Al2O3粉末溶于NaOH溶液中:Al2O3+2OH﹣=2AlO2﹣+H2O
C. 硫酸氢钠溶液与氢氧化钡溶液的反应:Ba2++SO42﹣=BaSO4↓
D. 氧化钠加入盐酸中:O2﹣+2H+═H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
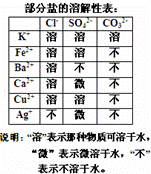
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl﹣、CO32﹣、SO42﹣,现每次取该溶液100.00mL溶液进行以下实验:
①第一份加入AgNO3溶液发现有沉淀生成;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥得沉淀2.33g.
请回答下列问题:
(1)根据以上实验判断,原溶液中可能存在的离子是 .
(2)原溶液中一定存在的阳离子是 ,其物质的量浓度至少为 mol/l.
(3)原溶液中一定存在的阴离子是﹣ ,其物质的量浓度分别为 mol/L、 mol/l.
查看答案和解析>>
科目:高中化学 来源: 题型:
目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列物质的分类不正确的是( )
|
| A. | SO2(氧化物) | B. | 碘酒(单质) | C. | HNO3(含氧酸) | D. | 氯水(混合物) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
|
| A. | HCl和NaOH反应的中和热△H=﹣57.3 kJ•mol﹣1,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ•mol﹣1 |
|
| B. | CO(g)的燃烧热是283.0 kJ•mol﹣1,则2CO2(g)═2CO(g)+O2(g)反应的△H=(2×283.0)kJ•mol﹣1 |
|
| C. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
|
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
过量的铜与浓硫酸在加热条件下的反应会因硫酸浓度下降而停止.为测定反应残余清液中硫酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量.
乙方案:与足量锌反应,测量生成氢气的体积.
回答下列问题:
(1)判定甲方案不可行,理由是 .
(2)甲同学用图1所示装置进行乙方案的实验.
①检查此装置气密性的方法
②使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中.残余清液与锌粒混合后的现象
③反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变.气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素).
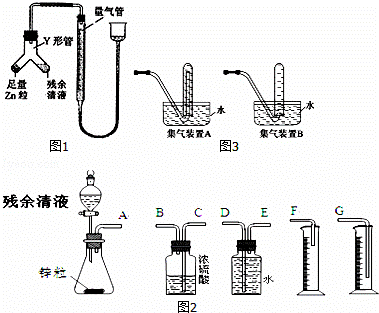
(3)乙同学拟选用图2实验装置完成实验:
①你认为最简易的装置其连接顺序是:A接 接 接 (填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后残余清液就不能顺利滴入锥形瓶.其原因是 .
③乙同学滴入锥形瓶中的残余清液体积为aml,测得量筒中水的体积为bml(假设体系中气体为标准状况),残余清液中硫酸的物质的量浓度的表达式 (用a、b表示)
④某学生想用排水法收集氢气,并检验其纯度,应选择图3集气装置 (填A或B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com