
�����仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺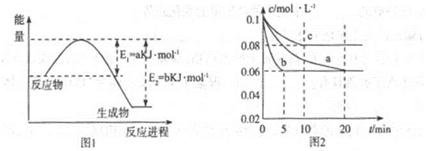
��1��ͼ1��1molNO2��1molCO��Ӧ����CO2��NO���������DZ仯ʾ��ͼ(a��b������0��)��֪:2CO(g)+2NO(g)=N2(g)+2CO2(g)��H=-ckJ��mol-1��c>0��
��д��CO��NO2��ԭ��N2ʱ���Ȼ�ѧ����ʽ____________��
��2��ͼ2��ʵ������������ͬ�������ܱ������кϳɰ�ʱ��N2��Ũ����ʱ��ı仯����(��a��b��c��ʾ������֪������������ʼ����Ũ�Ⱦ�Ϊ��c(N2)=0.1mol��L-1��c(H2)=0.3mol��L-1���ϳɰ��ķ�Ӧ��N2(g)+3H2(g) 2NH3(g)��H<0
2NH3(g)��H<0
�ټ�����a��ƽ��ʱH2��ת����Ϊ______��
����ͼ2��֪��b��c����һ��������a��ͬ����c�������ı������______��
��д���ж�b��a������ͬ������____________��
��3������ͼ2��c�����ºϳɰ����ݻ��̶�������֪��ѧƽ�ⳣ��K���¶�(T)�Ĺ�ϵ���±�:
����ȷ��K1����Դ�С��K1______4.1x106(��д��>����-����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ� ��______(�������ĸ����
A��������NH3��Ũ�ȱ��ֲ��� B��2v(N2)(����=v(H2)(�棩
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��4����NH4Cl��Һ�����Ե�ԭ����(�����ӷ�Ӧ����ʽ��ʾ )______��
��250Cʱ����pH=x��ˮ��pH=y������(��x+y=14,x>11)�������Ϻ�������Һ�и������ӵ�Ũ�ȹ�ϵ��ȷ����
A��[SO42-]>[NH4+]>[H+]>[OH-]
B��[NH4+]>[SO42-]>[OH-]>[H+]
C��[NH4+]+[H+]>[OH-]+[SO42-]
D��[NH4+]>[SO42-]>[H+]>[OH-]
(12��)
��1��4CO(g)+2NO2(g)=4CO2(g)+N2(g)��H=-(2b+c-2a)kJ��mol(2��)
��4CO(g)+2NO2(g)=4CO2(g)+N2(g)��H=(2a-2b-c)kJ��mol��
��2����40%(2��)
�������¶�(1��)����Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ�������b��a�������´ﵽƽ����N2��Ũ����ͬ�������������𰸣�(2��)��
��3��<(1��)��AC(2��)��
��4����NH+4+H2O=NH3��H2O+H+(2��)
��BC(2��)
���������������
��1�����������Ϣ���Եõ�����ʽNO2(g)+CO(g)=CO2(g)+NO(g)��H=-��b-a��kJ��mol����Ϣ�ʽ��2CO(g)+2NO(g)=N2(g)+2CO2(g)��H=-ckJ��mol-1��c>0�����ɢ١�2+�ڵ�CO��NO2��ԭ��N2ʱ���Ȼ�ѧ����ʽ��4CO(g)+2NO2(g)=4CO2(g)+N2(g)��H=-(2b+c-2a)kJ��mol
��2����ƽ��ʱ������Ũ��Ϊ0.06mol/L��ת������Ϊ0.04mol/L�����ݼ�����֮��H2ת������Ϊ0.12mol/L��H2��ת����Ϊ0.12mol/L��0.30mol/L��100%=40%���������¶Ⱥϳɰ��ķ�Ӧ��N2(g)+3H2(g) 2NH3(g)��H<0Ϊ���ȷ�Ӧ��������ת�����½��������˵���ƽ���ʱ�䣬�п��ܡ���Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ�������b��a�������´ﵽƽ��ʹN2��Ũ����ͬ��
2NH3(g)��H<0Ϊ���ȷ�Ӧ��������ת�����½��������˵���ƽ���ʱ�䣬�п��ܡ���Ϊ������������̴ﵽƽ���ʱ�䣬����ѧƽ�ⲻ�ƶ�������b��a�������´ﵽƽ��ʹN2��Ũ����ͬ��
��3���ٺϳɰ��ķ�Ӧ��N2(g)+3H2(g) 2NH3(g)��H<0Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K���С����ƽ��ʱ�������ʵ������䣬����A.������NH3��Ũ�ȱ��ֲ��䣬��ȷ��C.������ѹǿ���ֲ��䣬��ȷ��B.3v(N2)(����=v(H2)(�棩������D.�����Ǻ���������������������������䣬���������ܶȱ��ֲ��䣬����
2NH3(g)��H<0Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K���С����ƽ��ʱ�������ʵ������䣬����A.������NH3��Ũ�ȱ��ֲ��䣬��ȷ��C.������ѹǿ���ֲ��䣬��ȷ��B.3v(N2)(����=v(H2)(�棩������D.�����Ǻ���������������������������䣬���������ܶȱ��ֲ��䣬����
��4����NH4Cl��ˮ�⣺NH4++H2O=NH3��H2O+H+���ڣ���x+y=14����ˮ���������OH-����������ȫ�������H+��˵����ˮҪԶ�������ᣬ�������Ϻ���Һһ���ʼ���[H+]<[OH-]����ϵ���غ�ʽ��
[NH4+]+[H+]=[OH-]+2[SO42-]����֪BC��ȷ��
���㣺�����˹���ɡ���ѧƽ����������ƶ����������Լ��������Һ֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��ij��ѧ��ȤС��Ҫ��ɷ�Ӧ�ȵIJⶨ��ʵ�����ϱ����ձ�����С�����ձ�������ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β�����������0��50mol�� L��1���ᡢ0��50mol�� L��1NaOH��Һ��ʵ����ȱ�ٵIJ�����Ʒ��_____________��_______________��
��2����֪2molCO������ȫȼ������CO2 ����ų�566 kJ������1 mol������ȫȼ������Һ̬ˮ�ų�286 kJ������1 molCH4������ȫȼ������CO2�����Һ̬ˮ�ų�890 kJ������д���ñ�ȼ������Ϊ��Ӧ�ȵ�COȼ�յ��Ȼ�ѧ����ʽ__________________��
��1 molCH4������ȫȼ������CO2�����Һ̬ˮ���ų�����_____890 kJ�� ������� ����������=����������a molCH4��CO��H2�Ļ��������ȫȼ�գ����� CO2�����Һ̬ˮ����CO2��ˮ�����ʵ������ʱ����ų�������Q���ĵ�ȡֵ��Χ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����(H2NCONH2)��һ�ַdz���Ҫ�ĸߵ����ʣ��ڹ�ũҵ���������ŷdz���Ҫ�ĵ�λ��
��1����ҵ�Ϻϳ����صķ�Ӧ���£�
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) ��H=-103��7 kJ��mol-1
H2O(l)+H2NCONH2(l) ��H=-103��7 kJ��mol-1
���д�ʩ��������������ص��������ʵ���
| A�����ø��� |
| B�����ø�ѹ |
| C��Ѱ�Ҹ���Ч�Ĵ��� |
| D����С��ϵ��CO2Ũ�� |
 H2NCOONH4(���������)(l) ��H1
H2NCOONH4(���������)(l) ��H1 H2O(l)+H2NCONH2(l) ��H2��
H2O(l)+H2NCONH2(l) ��H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����P��s����Cl2������Ӧ����PCl3��PCl5����Ӧ���̺�������ϵ��ͼ��ʾ��ͼ�еġ�H��ʾ����1mol��������ݣ�
��ͼ�ش���������
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ ��
��2��PCl5�ֽ�����PCl3��Cl2���Ȼ�ѧ����ʽ ��
�����ֽⷴ��һ�����淴Ӧ���¶�T1ʱ�����ܱ������м���0.8mol PCl5����Ӧ�ﵽƽ��ʱ��ʣ��0.6mol PCl5����ֽ��ʦ�1���� ������Ӧ�¶���T1���ߵ�T2��ƽ��ʱPCl5�ֽ��ʦ�2����2 ��1������ڡ�����С�ڡ����ڡ�����
��3����ҵ���Ʊ�PCl5ͨ�����������У��Ƚ�P��Cl2��Ӧ�����м����PCl3��Ȼ���£��ٺ�Cl2��Ӧ����PCl5��ԭ���� ��
��4��P��Cl2��������Ӧ����1mol PCl5�ġ�H3= ��P��Cl2һ����Ӧ����1mol PCl5�ġ�H4 ��H3 ������ڡ�����С�ڡ����ڡ�����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������Ȼ�ѧ����ʽ����ѧ����ʽ���缫��Ӧʽ������ʽ�ȣ�����д��
��1����֪��2Cu(s)��1/2O2(g)=Cu2O(s)����H = -169kJ��mol-1��
C(s)��1/2O2(g)=CO(g)����H = -110.5kJ��mol-1��
Cu(s)��1/2O2(g)=CuO(s)����H = -157kJ��mol-1
��̿���ڸ��������»�ԭCuO����Cu2O���Ȼ�ѧ����ʽ�ǣ�
��2����һ�������£���������������������·�Ӧ��2SO2(g)+O2(g) 2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��
2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��
��3���Լ��顢����Ϊ��Ӧ�KOH��Һ���������Һ����ȼ�ϵ�أ�����ӦʽΪ�� ��
��4����ˮAlCl3ƿ�Ǵ��а������䷴Ӧ�Ļ�ѧ����ʽΪ ��
��5����þ���������Ρ�ȼ�ϵ�أ���װ��ʾ��ͼ��ͼ���õ�ط�Ӧ���ܷ�Ӧ����ʽΪ_____________________��
��6����ҵ�ϵ�ⱥ��ʳ��ˮ�����ӷ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о����仯������ڹ�ũҵ����������Ҫ���塣
��1��ͼ����ʾһ���ݻ�Ϊ4L���ܱ����������п��ƶ��ĸ��塣һ���¶ȣ�T���£����Ҽ���2 mol SO3�����Ҽ���2 mol SO2��1 mol O2�����������������·ֱ�����Ӧ��
���ң�
���ң�
��Ӧ�ﵽƽ��ʱ�����ҷ�Ӧ���̺�������ϵ��ͼ����ʾ��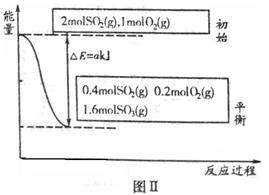
�٦�H2��_______����a����ѧʽ��ʾ������Ӧ��ƽ�ⳣ��K��_________L��mol��1��
����˵�����߷�Ӧһ���ﵽƽ�����______________������ţ���
A�����岻���ƶ�
B����������SO2�����ʵ������
C�����Ҷ�����SO2��O2���ʵ���֮�ȶ���2��1
�۴�ƽ��ʱ�����ҷ�Ӧ���յ�����ΪQ1kJ�����ҷ�Ӧ���յ�����ΪQ2kJ����Q1��Q2����Ĺ�ϵ��_____________������ţ���
A��Q1��Q2
B��Q1��Q2
C��Q1��Q2
��2�������£����ȵ�Cu2S��ˮ������Ӧ���ɽ���ͭ��H2��SO2�� ����
����
��д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ_____________________________________________��
������1 mol Cu2S���뷴Ӧ����ת�Ƶ��ӵ����ʵ�����_________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���÷�Ӧԭ���о��������ȡ��⼰�仯����ķ�Ӧ����Ҫ���塣
��1���ڷ�Ӧ��2SO2(g)+O2(g) 2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����
2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����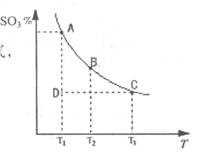
��2SO2(g)+O2(g) 2SO3(g)�ġ�H 0���>����<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ�������������ҡ���������
2SO3(g)�ġ�H 0���>����<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ�������������ҡ���������
�ڵ��¶�ΪT1����Ӧ���е�״̬Dʱ��V�� V�����>������<����=������
��2������ͼ��һ�������£�N2��H2�������淴Ӧ����1mol NH3�������仯ͼ���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ ��(��H�ú�Q1��Q2�Ĵ���ʽ��ʾ��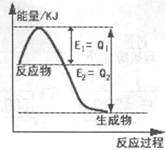
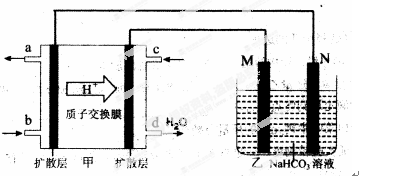
��25��Cʱ����a mol ? L�D1�İ�ˮ��b mol ? L�D1������������ϣ�������Һ��pH=7����c (NH4+) c(Cl�D)��a b���>������<����=������
��3����ˮ�к��д����Ի���̬��ʽ���ڵ��ȡ���Ԫ�ء���֪��250Cʱ��Ksp(AgCl)=1.6��10�D10mol2?L�D2��Ksp(AgI)=1.5��10�D16mol2?L�D2��
�� 250Cʱ���� 10mL0.002mol?L�D1�� NaCl��Һ�е��� 10mL0.002mol?L�D1AgNO3��Һ���а�ɫ�������ɣ���������Һ�м�������0.1mol ?L�D1��NaI��Һ����ɫ������ת��Ϊ��ɫ��������ԭ���� ���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���һ�ֳ��õ�ȼ�ϣ���ҵ�Ͽ�����CO��H2��һ�������ºϳɼ״���
��1����֪CO��g����H2��g����CH3OH��1����ȼ���ȡ�H�ֱ�Ϊ��-283.0kJ��mol��-285.8 kJ/mol��-726.5kJ/mol����CO�ϳɼ״����Ȼ�ѧ����ʽΪ�� ��
��2���ں����ܱ�������CO��H2������Ӧ���ɼ״���������Ũ���ڲ�ͬ�����µı仯״����ͼ��ʾ����ʼʱ������Ũ�����ߺ�8���Ӻ�״���Ũ������δ������4���Ӻ�8���Ӹı��������ͬ���� 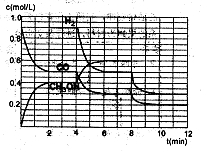
������˵����ȷ����
| A����ʼʱn��H2��Ϊ1��7mol |
| B����������ѹǿ�㶨ʱ��˵����Ӧ�ﵽƽ��״̬ |
| C��4����ʱ���ı�������������¶� |
| D��7����ʱ��v��CO��=v��CH3OH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��1��H2S��ȼ���Ȧ�H�� ��a kJ��mol��1����H2Sȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ ��
��2����֪�������£����ܱ���������H2��ԭWO2�ɵõ������١����¶ȹ���ʱ��WO2(s)��ת��ΪWO2 (g)����������·�Ӧ��
WO2 (s) + 2H2 (g)  W (s) + 2H2O (g)����H�� +66.0 kJ�� mol��1
W (s) + 2H2O (g)����H�� +66.0 kJ�� mol��1
WO2 (g) + 2H2 W (s) + 2H2O (g)����H �� ��137.9 kJ�� mol��1
W (s) + 2H2O (g)����H �� ��137.9 kJ�� mol��1
�����WO2 (s)  WO2 (g) �Ħ�H �� ______________________��
WO2 (g) �Ħ�H �� ______________________��
��3����ҵ�ϳ�������Ȼ��(��Ҫ�ɷ�ΪCH4)��CO2���и��������Ʊ�CO����Ӧ�Ļ�ѧ����ʽΪ��
CH4 + CO2 =" 2CO" + 2H2
��֪CH4��H2��CO��ȼ���ȷֱ�Ϊ890.3 kJ��mol-1��285.8 kJ��mol-1��283.0 kJ�� mol-1��������1 m3(��״��)CO��������Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com