
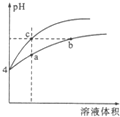
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )| A. | a、b、c三点溶液的Kw相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
分析 HCl是强电解质,完全电离,氯化铵水解导致溶液呈酸性,加水稀释促进氯化铵水解,pH相同的盐酸和氯化铵,稀释相同的倍数,氯化铵中氢离子浓度大于HCl,所以氯化铵pH小于HCl,根据图象知,上面的曲线是HCl、下面的曲线是氯化铵,
A.温度不变,水的离子积常数不变;
B.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
C.pH相等的氯化铵和HCl溶液,氯化铵浓度大于HCl,相同体积的氯化铵和HCl,物质的量越大其消耗NaOH体积越大;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离;盐溶液中,氢离子浓度越小,水的电离程度越大.
解答 解:HCl是强电解质,完全电离,氯化铵水解导致溶液呈酸性,加水稀释促进氯化铵水解,pH相同的盐酸和氯化铵,稀释相同的倍数,氯化铵中氢离子浓度大于HCl,所以氯化铵pH小于HCl,根据图象知,上面的曲线是HCl、下面的曲线是氯化铵,
A.温度不变,水的Kw不变,三种溶液温度相等,所以Kw相等,故A正确;
B.任何电解质溶液中都存在质子守恒,根据质子守恒得c(OH-)+c(NH3•H2O)=c(H+),故B错误;
C.pH相等的氯化铵和HCl溶液,浓度:NH4Cl>HCl,相同体积的NH4Cl和HCl,物质的量越大其消耗NaOH体积越大,物质的量NH4Cl>HCl,所以NH4Cl消耗NaOH多,则Vb>Vc,故C正确;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离;盐溶液中,氢离子浓度越大,水的电离程度越大,所以a、b、c三点溶液中水的电离程度a>b>c,故D正确;
故选B.
点评 本题以盐类水解为载体考查离子浓度大小比较,明确盐类水解特点及对水电离影响是解本题关键,结合质子守恒分析解答,易错选项是D,注意水的离子积常数只与温度有关,与溶液酸碱性及浓度无关.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题
 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:Z<M | D. | 得电子能力:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是重要的化工原料,用途很广.
氨是重要的化工原料,用途很广. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
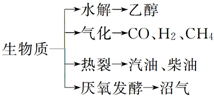 “地沟油”被称为“生物燃料”,该燃料属于生物质能.已知生物质的主要转化途径及主要产物如图所示.则下列关于生物燃料以及生物质能的说法中正确的是( )
“地沟油”被称为“生物燃料”,该燃料属于生物质能.已知生物质的主要转化途径及主要产物如图所示.则下列关于生物燃料以及生物质能的说法中正确的是( )| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
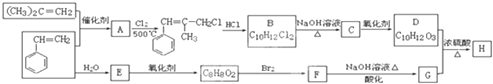
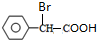 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$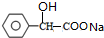 +NaBr+H2O.
+NaBr+H2O.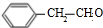 .
.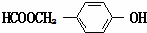 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
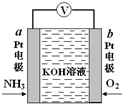 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| C. | O2在电极b上发生还原反应 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸凝胶经干燥脱水后得到“硅胶”,常用作干燥剂,也可以用作催化剂的载体 | |
| B. | 金属表面形成的氧化物都能起到保护内层金属的作用 | |
| C. | 煤与氢气作用生成液体燃料,也可以间接液化,先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇 | |
| D. | 含氮和磷的大量污水任意排放向近海海域会出现水华、赤潮等污染问题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com