
常温下,下列各组微粒在指定的溶液中一定能大量共存的是
A.c(OH—)=10—13mol·L—1的溶液中:Na+、NH4+、Cl—、NO3—
B.1.0 mol·L—1KI溶液中:Mg2+、Fe2+、SO42—、C1O—
C.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、NH4+、HCO3-、SCN—
D.饱和氨水中:NH4+、Ag+、SO42-、NO3—
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
下列类比关系正确的是
A.钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气 体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。
体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。
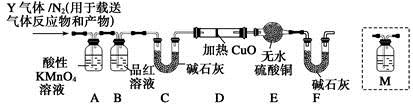

(3)装置B中试剂的作用是 。
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于
(填序号)。
A.A之前 B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
与CH2=CH2®CH2Br—CH2Br的变化属于同一反应类型的是( )
A.CH3CHO®C2H5OH B.C2H5Cl®CH2=CH2
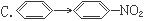 D.CH3COOH®CH3COOC2H5
D.CH3COOH®CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,已知0.1mol·L-1的CH3COOH和HCN溶液的PH分别为a、b,且1<a< b。下列有关叙述不正确的是( )

A.常温下,等浓度的CH3COONa溶液和NaCN溶液的PH前者较小
B.在NaCN溶液中:c (Na+)+ c (H+) =c (OH-)+ c (CN-)
C.相同温度下,相同PH的CH3COOH和HCN溶液分别加水稀释,溶液PH随溶液体积变化的曲线如图1所示
D.常温下,CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与盐浓度的变化曲线如图2所示
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是
A.F2、K、HCl B.Cl2、Al、H2
C.SO2、Na、Br2 D.O2、SO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01 mol·L-1(填“>”、“ <”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.未用标准液润洗碱式滴定管;
B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.1 mol Na202固体中含离子总数为4NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com