
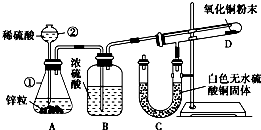
 某同学为了验证氢气还原氧化铜的反应产物,设计了如图所示的实验装置.
某同学为了验证氢气还原氧化铜的反应产物,设计了如图所示的实验装置.
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
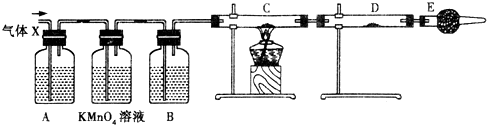
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?惠州模拟)已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.
(2011?惠州模拟)已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,而Cu2O在空气中灼烧可以生成CuO.| 方案甲 | 取该红色沉淀溶于稀硫酸中,观察是否有残渣. |
| 方案乙 | 取该红色沉淀溶于稀硝酸中,观察溶液颜色. |
| 方案丙 | 称取红色沉淀a g,在空气中充分灼烧至完全变成b g黑色的CuO,比较a和b的关系. |
查看答案和解析>>
科目:高中化学 来源: 题型:
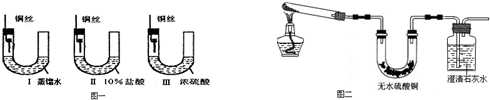
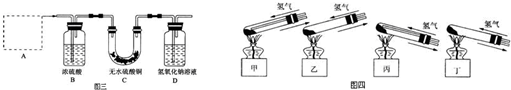
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省石家庄市第一中学高一上学期期中考试化学试卷(带解析) 题型:实验题
Ⅰ 某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。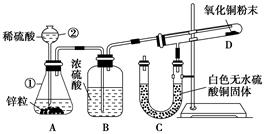
(1)写出编号仪器的名称:①____ ____ ②_____ ___。
(2)浓硫酸的作用是____________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1mol水分子,转移的电子数为________个。
Ⅱ 实验时他需要1.0mol/L的硫酸溶液250mL。根据溶液的配制回答下列问题。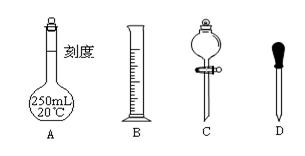
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀。
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL,如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市高一上学期期中考试化学试卷(解析版) 题型:实验题
Ⅰ 某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。
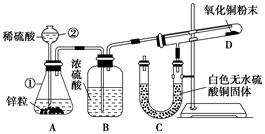
(1)写出编号仪器的名称:①____ ____ ②_____ ___。
(2)浓硫酸的作用是____________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1mol水分子,转移的电子数为________个。
Ⅱ 实验时他需要1.0mol/L的硫酸溶液250mL。根据溶液的配制回答下列问题。
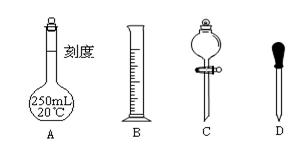
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀。
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL,如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com