
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
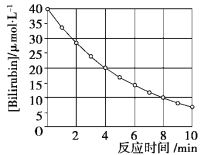
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】用0.1molL-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1molL-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法不正确的是( )

A.NaX溶液呈碱性B.P点:c(Na+)>c(H+)
C.M点:c(HX)+c(X-)=2c(Na+)D.M点水电离程度小于N点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3H2O![]() +OH-,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适量的物质是(忽略溶解热)
+OH-,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适量的物质是(忽略溶解热)
①NH4Cl 固体 ②硫酸 ③NaOH 固体 ④水 ⑤加热
A.仅①②③⑤B.仅③⑤C.仅③D.仅①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是
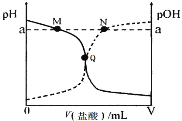
A.M点所示溶液c(![]() )+c(NH3·H2O)= c(Cl-)
)+c(NH3·H2O)= c(Cl-)
B.N点所示溶液中:c(![]() )>c(Cl-)
)>c(Cl-)
C.Q点所示消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的离子积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
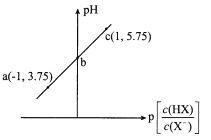
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
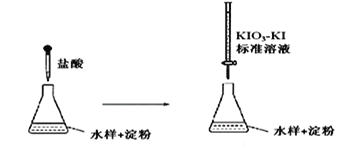
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
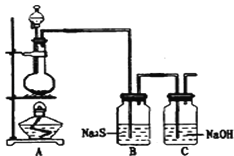
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锈的主要成分有 Cu2(OH)2CO3 和 Cu2(OH)3Cl,结构如图所示。考古学家将铜锈分为无害锈和有害锈, 下列说法不正确的是( )

A.上述铜锈的形成过程中,铜均为负极
B.Cu2(OH)2CO3 结构致密,属于无害锈
C.在文物表面涂抹饱和食盐水,能够对文物起到保护作用
D.上述铜锈的形成过程中,正极电极反应式均为O2+4e+2H2O=4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
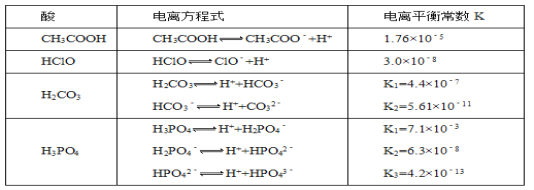
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是___________(填化学式,下同),最弱的是_________________
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__________________________,1.2molL﹣1的NaClO溶液pH=__________________________(已知:lg2=0.3)。
(3)求出该温度下,0.10molL﹣1的CH3COOH溶液中的c(H+)=____________molL﹣1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com