
| A. | 属于置换反应 | B. | 碳发生了还原反应 | ||
| C. | 二氧化硅是氧化剂 | D. | 24g碳充分反应生成28g硅 |
分析 本题应根据物质的种类和数目判断反应的类型,从得氧失氧的角度来认识氧化和还原反应,SiO2和CO都是化合物,也是氧化物,C和Si是单质,由此分析解答.
解答 解:A、该反应是一种单质和一种化合物反应生成了一种新的单质和新的化合物的反应,是置换反应,故A正确;
B、碳在反应中得到氧元素,被氧化,是还原剂,发生了氧化反应,故B错误;
C、二氧化硅在反应中失去氧元素,被还原,是氧化剂,所以二氧化硅发生了还原反应,故C正确;
D、由反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,24g碳充分反应生成28g硅,故D正确.
故选B.
点评 本题应注意从不同的角度来认识和分析化学反应,注重反应前后的变化,能从细微之处去分析反应,解答本题要掌握判断反应类型的方法,只有这样才能对各种反应类型做出正确的判断.


科目:高中化学 来源: 题型:解答题
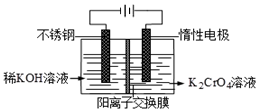 已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.
已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
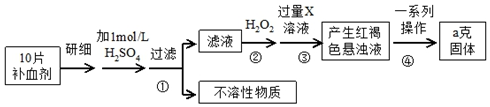
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO3与H2O2的反应为氧化还原反应 | |
| B. | 因为SO2有漂白性,所以SO2可使溴水褪色 | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL溶液中的阴、阳离子总数为0.3NA | |
| B. | 500 mL溶液中NO3-离子浓度为0.2mol/L | |
| C. | 500 mL溶液中Ba2+离子浓度为0.2mol/L | |
| D. | 500 mL溶液中NO3-离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 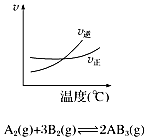 如图说明此反应的正反应是吸热反应 | |
| B. | 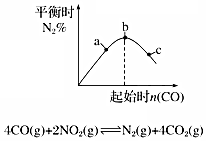 如图说明NO2的转化率b>a>c | |
| C. |  如图说明反应至15 min时,改变的条件是升高温度 | |
| D. |  如图说明生成物D一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制100mL该溶液需用5.85g NaCl | |
| B. | 该溶液的物质的量浓度为1mol•L -1 | |
| C. | 该溶液中含有58.5g NaCl | |
| D. | 量取100mL该溶液,其中Na+的物质的量为0.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com