
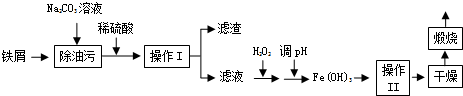
分析 铁屑加入碳酸钠溶液除去油污后加入稀硫酸溶解反应生成硫酸亚铁,过滤得到滤液为硫酸亚铁溶液,加入过氧化氢氧化亚铁离子为铁离子,加入铁的氧化物调节溶液PH是铁离子全部沉淀,过滤洗涤得到氢氧化铁固体,干燥后煅烧得到氧化铁,
(1)碳酸钠溶液水解显碱性,油脂在碱溶液中水解生成溶于水的物质,洗涤除去,提高去油污速率的方法可以加热促进水解;
(2)亚铁离子检验可以选择高锰酸钾溶液检验亚铁离子的存在;
(3)操作Ⅰ是分离固体和溶液的操作为过滤;
(4)加入物质调节溶液PH是促进铁离子水解且不引入新的杂质;
(5)操作Ⅱ是过滤得到沉淀,洗涤沉淀得到较纯净的沉淀;
(6)煅烧制得产品的反应时氢氧化铁分解生成氧化铁和水;四氧化三铁为磁性氧化物,可以用铁析出;
解答 解:(1)碳酸钠溶液水解显碱性,油脂在碱溶液中水解生成溶于水的物质,洗涤除去,提高去油污速率的方法可以加热促进水解,减小增强洗涤效果好,
故答案为:加热;
(2)亚铁离子检验可以选择高锰酸钾溶液检验亚铁离子的存在,检验滤液中含有Fe2+的方法是:取滤液少许与试管中,滴入高锰酸钾溶液弱紫色褪去说明含亚铁离子,
故答案为:取滤液少许与试管中,滴入高锰酸钾溶液弱紫色褪去说明含亚铁离子;
(3)操作Ⅰ是分离固体和溶液的操作为过滤,操作Ⅰ的名称是:过滤,
故答案为:过滤;
(4)加入物质调节溶液PH是促进铁离子水解且不引入新的杂质,
A.NaOH溶液加入会引入钠离子杂质,故A错误;
B.CaO加入可以调节溶液PH,但会引入杂质离子钙离子,故B错误;
C.FeO 加入可以调节溶液PH,且不引入杂质离子,故C正确;
D.Fe2O3加入可以调节溶液PH,且不引入杂质离子,故D正确;
故答案为:CD;
(5)操作Ⅱ是过滤得到沉淀,洗涤沉淀得到较纯净的沉淀,操作Ⅱ包含的两项基本操作是沉淀,洗涤,
故答案为:沉淀,洗涤;
(6)煅烧制得产品的反应时氢氧化铁分解生成氧化铁和水,反应的化学方程式为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,四氧化三铁为磁性氧化物,可以用铁吸出;
故答案为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;用铁吸出;
点评 本题考查了物质制备的流程分析、物质分离实验操作、物质性质等知识点,掌握基础是解题关键,题目难度中等.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
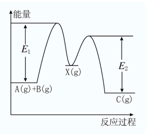 反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )| A. | △H=E1-E2 | B. | E1是反应①的活化能 | ||
| C. | X是反应A(g)+B(g)→C(g)的催化剂 | D. | △H2>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和溶液的密度$\frac{(a+b)}{V}$ | |
| B. | 饱和溶液的物质的量浓度$\frac{100a(M-18x)}{MV}$ | |
| C. | 25℃,R的溶解度$\frac{100a(M-18x)}{(bM+18ax)}$ | |
| D. | 饱和溶液的质量分数$\frac{a(M-18x)}{(a+b)M}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶液跟盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 盐酸跟氢氧化镁溶液反应:H++OH-═H2O | |
| D. | 氢氧化钡跟硫酸铜反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
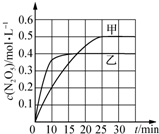 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)十O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图所示:| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物 | |||
| 起始量 | 2mol NO2 | ||
| 1mol O3 | 2mol NO2 | ||
| 1mol O3 | 2mol N2O5 | ||
| 1mol O2 | |||
| 温度/K | T1 | T2 | T2 |
| A. | 0~10 min内甲容器中反应的平均速率:v(NO2)=0.02 mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1K时,若起始时向容器甲中充入2 mol NO2、1 mol O3、2 mol N2O5和2 mol O2,则脱硝反应达到平衡前,v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s),△H=-216kJ•mol-1,反应物总能量小于生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(1),△H=-571.6kJ•mol-1,若生成气态水,△H小于-571.6kJ•mol-1 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com