
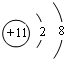 ;1124Na.
;1124Na.分析 有X、Y、Z三种元素,X元素一种原子的质量数是24,中子数是13,X的质子数=24-13=11,则X为Na元素;Y元素原子核内无中子,则Y为H;Z元素原子核内有8个质子,其原子序数为8,则Z为O元素,据此结合元素周期律知识进行解答.
解答 解:X元素一种原子的质量数是24,中子数是13,X的质子数=24-13=11,则X为Na元素;Y元素原子核内无中子,则Y为H元素;Z元素原子核内有8个质子,其原子序数为8,则Z为O元素,
(1)根据分析可知,Z为O元素,故答案为:O;
(2)X、Y、Z分别为Na、H、O元素,三种元素组成的化合物为NaOH,氢氧化钠在水中的电离方程式为:NaOH=Na++OH-,故答案为:NaOH=Na++OH-;
(3)X为Na元素,X元素的简单离子为钠离子,钠离子的结构示意图为: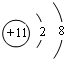 ;Na原子的核电荷数为11,中子数为13,其核素符号为:1124Na,
;Na原子的核电荷数为11,中子数为13,其核素符号为:1124Na,
故答案为: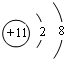 ;1124Na;
;1124Na;
(4)X为Na、Z为O,则X2FeZ4为Na2FeO4,Na2FeO4消毒净水原理是铁+6价是最高价态,所以只能得电子而作氧化剂,氧化剂具有氧化性,其产物是还原产物;有时胶体和溶液外观上难以区别,可用丁达尔效应实验加以区别,
故答案为:氧化性;还原产物;丁达尔效应.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,注意掌握元素周期表结构、元素周期律的内容,(4)需要根据化合价变化判断氧化性、还原性,还要明确区别胶体和溶液的常用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸和醋酸分别与锌反应放出的氢气一样多 | |
| C. | 醋酸与锌反应所需时间长 | |
| D. | 盐酸和醋酸分别与锌反应所需时间一样长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
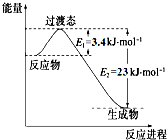 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
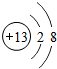 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3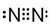 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com