
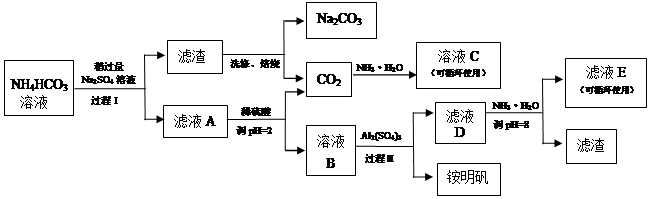
 Al(OH)3 + 3H+
Al(OH)3 + 3H+ NaHCO3(s),Na+浓度增大平衡向正反应方向移
NaHCO3(s),Na+浓度增大平衡向正反应方向移 Al(OH)3 + 3H+;(3)NH4HCO3易受热分解,故反应应控制温度;(4)在平衡体系中增加一种反应物的浓度,反应正向进行,提高另外反应物的转化率;(5)双水解反应;(6)A为(NH4)2SO4和剩余的硫酸盐和碳酸盐,B主要为NH4HSO4,D主要为剩余的NH4HSO4、Al2(SO4)3,E为(NH4)2SO4;(7)明矾铵的溶解度随着温度的升高而增大,故采用降温结晶的方法分离,因滤液浓度低,所以需要浓缩,方法为蒸发浓缩、降温结晶(冷却结晶)。
Al(OH)3 + 3H+;(3)NH4HCO3易受热分解,故反应应控制温度;(4)在平衡体系中增加一种反应物的浓度,反应正向进行,提高另外反应物的转化率;(5)双水解反应;(6)A为(NH4)2SO4和剩余的硫酸盐和碳酸盐,B主要为NH4HSO4,D主要为剩余的NH4HSO4、Al2(SO4)3,E为(NH4)2SO4;(7)明矾铵的溶解度随着温度的升高而增大,故采用降温结晶的方法分离,因滤液浓度低,所以需要浓缩,方法为蒸发浓缩、降温结晶(冷却结晶)。

科目:高中化学 来源:不详 题型:填空题
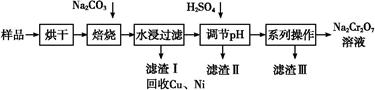
 Na2CrO4+ CO2+
Na2CrO4+ CO2+  Cr2O72—+H2O
Cr2O72—+H2O| 温度 溶解度 化学式 | 20 ℃ | 60 ℃ | 100 ℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.大量铝土矿 | B.电解氧化铝制取铝的方法 |
| C.用金属钠还原氧化铝的方法 | D.无水氯化铝与钾制取铝的方法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
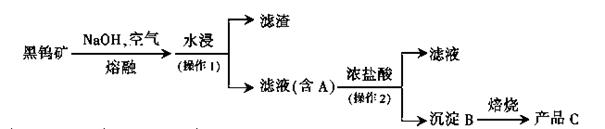
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
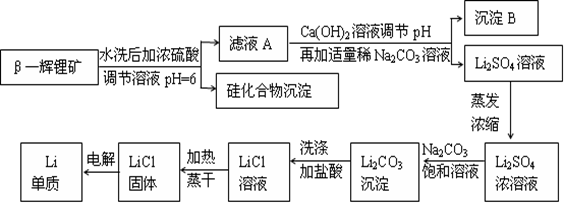
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
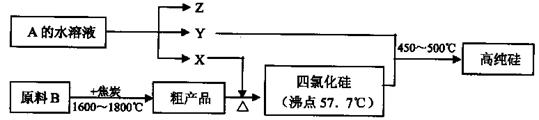
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 金属 | 冶炼原理 |
| A | Fe | Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
| B | Hg | 2HgO 2Hg+O2↑ 2Hg+O2↑ |
| C | Mg | 2MgO(熔融)  2Mg+O2↑ 2Mg+O2↑ |
| D | Na | 2NaCl(熔融)  2Na+Cl2↑ 2Na+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.城市采用分质供水,收集雨水进行综合利用 |
| B.推广煤的气化、液化技术,提供清洁高效燃料 |
| C.大力发展汽车产业,鼓励市民购买家用汽车 |
| D.开发利用太阳能、风能、氢能、核能等能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com