
| A. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=-485 kJ•mol - 1 | |
| B. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=+485 kJ•mol - 1 | |
| C. | 2H 2(g)+O 2(g)═2H 2O(g)△H=+485 kJ•mol - 1 | |
| D. | 2H 2(g)+O 2(g)═2H 2O(g)△H=-485 kJ•mol - 1 |
分析 化学反应中,旧键断裂需要吸收能量,新键的生成会放出能量,反应焓变△H=反应物的键能和-生成物的键能和,注意放热反应的焓变△H<0,吸热反应的焓变△H>0,据此进行解答.
解答 解:A.水的分解是吸热反应,焓变△H>0,故A错误;
B.反应H2O(g)═H2(g)+$\frac{1}{2}$O2(g)的△H=2×463kJ/mol-436kJ/mol-$\frac{1}{2}$×495kJ/mol=242.5kJ/mol,故B错误;
C.氢气燃烧放热,应该△H<0,应该为负值,故C错误;
D.反应2H2(g)+O2(g)═2H2O(g)的△H=2×436kJ/mol+495kJ/mol-4×463kJ/mol=-485kJ/mol,故D正确;
故选D.
点评 本题考查了热化学方程式的书写、反应热的计算,题目难度中等,注意掌握热化学方程式的书写原则,明确化学键与化学反应中能量变化的关系是解题关键,试题培养了学生的分析能力及化学计算能力.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液浓度偏高 | |
| B. | 量取15.20mL AgNO3溶液可以用酸式滴定管 | |
| C. | 过滤完毕,洗涤沉淀时应该向漏斗中加水至没过沉淀,用玻璃棒搅拌充分洗剂,重复2~3次 | |
| D. | 蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌防止溶液溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银、氨水 | B. | 硫酸亚铁溶液、氢氧化钠溶液 | ||
| C. | 明矾溶液、氢氧化钡溶液 | D. | 氯化铝溶液、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
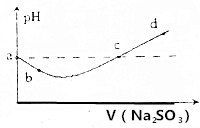
| A. | a点表示的溶液中存在3种分子,3种离子 | |
| B. | b点溶液中不存在SO2 | |
| C. | c点溶液中c(Na+)=2c(HSO3-)+2c(SO32-) | |
| D. | d点溶液中不存在HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗1 mol CH3CH2OH时转移电子的物质的量为4mol | |
| B. | 1mol/L CH3COOH溶液中含有σ键的数目为7NA个 | |
| C. | H2F+、NH2-、H2S、CH4均与H2O互为等电子体 | |
| D. | 在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
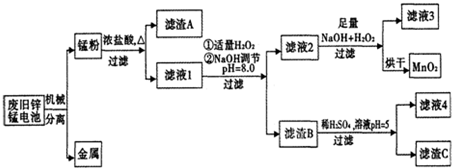
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com