
| A. | 7.8g 苯中含有的单键数目为0.9NA | |
| B. | 1 mol Cl2溶于水,与水反应时电子转移数目为1 NA | |
| C. | 在298K 1.01×105pa下,22 g CO2和N2O混合气体中,所占的体积大于11.2升 | |
| D. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA |
分析 A、苯不是单双键交替的结构;
B、氯气和水的反应为可逆反应;
C、CO2和N2O的摩尔质量均为44g/mol;
D、溶液体积不明确.
解答 解:A、苯不是单双键交替的结构,故苯中无碳碳单键,故A错误;
B、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于NA个,故B错误;
C、CO2和N2O的摩尔质量均为44g/mol,故22g混合物的物质的量为0.5mol,而298K 1.01×105pa下,气体摩尔体积大于22.4L/mol,故0.5mol混合气体的体积大于11.2L,故C正确;
D、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.022mol•L-1 | B. | 0.045mol•L-1 | C. | 0.8mol•L-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 氧化铝是冶炼金属铝的原料,也是一种较好的耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100 mL容量瓶配制50 mL 0.1 mol/L盐酸 | |
| B. | 在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量 | |
| C. | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| D. | 用托盘天平准确称取5.85 g NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | N | O | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | 100mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA | |||||||||||
| C. | 已知:
 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
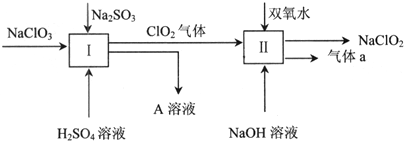
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com