
 2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
| A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0375mol·L-1·min-1 |
| B.保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
| C.保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用右图表示 |
| D.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )| | 起始时各物质的物质 的量(mol) | 达到平衡时能量变化 | ||
| 容器编号 | N2 | H2 | NH3 | |
| ① | 1 | 3 | 0 | 放出23.15 kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出Q kJ能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是( )
N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是( )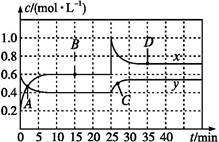
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与盐酸反应产生氢气 |
| B.在氯气中燃烧 |
| C.放入硝酸汞溶液中表面形成铝汞齐 |
| D.一定温度下,用铝与氧化钙反应制得金属钙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 A2(g) +B2(g),不能确定达到平衡状态的是
A2(g) +B2(g),不能确定达到平衡状态的是| A.单位时间内生成n mol A2,同时生成2n molAB |
| B.单位时间内生成n mol B2,同时生成2n molAB |
| C.AB的消耗速率等于A2的消耗速率 |
| D.容器中各组分的物质的量分数不随时间变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
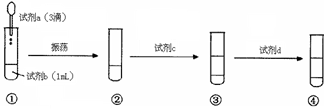
| A.试剂a是0.1mol·L–1KI溶液 |
| B.试剂d是KSCN溶液 |
| C.说明该反应已经发生的理由是③的下层呈紫色 |
| D.说明该反应是有限度的实验现象是④的上层溶液出现血红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
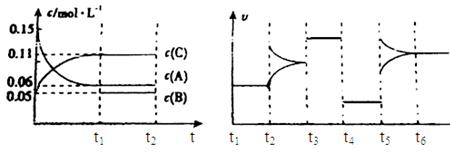
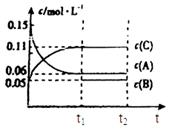
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NiO(s)+H2(g)的平衡常数K=0.0059。当水蒸气和氢气的物质的量浓度相等时,此反应
NiO(s)+H2(g)的平衡常数K=0.0059。当水蒸气和氢气的物质的量浓度相等时,此反应| A.已达平衡状态 | B.未达平衡状态,反应正向进行 |
| C.未达平衡状态,反应逆向进行 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
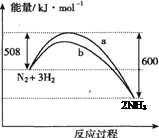
A.该反应的热化学方程式为:N2 + 3H2 2NH3ΔH =-92 kJ/mol 2NH3ΔH =-92 kJ/mol |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.曲线b表示可能使用了催化剂 |
| D.降低温度和缩小容器体积均可使该反应平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com