
分析 ①硝酸根离子为-1价,根据化合物中各元素化合价的代数和为0知,M元素在该化合物中化合价为+1价,电路中转移电子为0.4mol,则n(M)=n(e-)=0.4mol,M=$\frac{m}{n}$,数值上金属元素的摩尔质量等于其相对原子质量;
②根据“析出什么加入什么”原则加入物质,电解硫酸钾溶液时,阳极上析出氧气、阴极上析出氢气,所以相当于电解水,根据转移电子和析出物质之间的关系式计算;
③电解0.2molNaCl,氯离子完全放电转移电子物质的量为0.2mol,还有0.2mol电子是氢氧根离子转移的;电解过程分为两步:第一步电解反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、第二步电解反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,根据c(NaOH)计算溶液pH.
解答 解:①硝酸根离子为-1价,根据化合物中各元素化合价的代数和为0知,M元素在该化合物中化合价为+1价,电路中转移电子为0.4mol,则n(M)=n(e-)=0.4mol,M=$\frac{m}{n}$=$\frac{43.2g}{0.4mol}$=108g/mol,数值上金属元素的摩尔质量等于其相对原子质量为108,故答案为:108;
②根据“析出什么加入什么”原则加入物质,电解硫酸钾溶液时,阳极上析出氧气、阴极上析出氢气,所以相当于电解水,生成1mol水转移电子2mol电子,则转移0.4mol电子生成n(H2O)=$\frac{0.4mol}{2}×18g/mol$=3.6g,需要进行的操作是向溶液中加入3.6g水即可,故答案为:向溶液中加入3.6g水;
③电解0.2molNaCl,氯离子完全放电转移电子物质的量为0.2mol,根据Cl原子守恒得n(Cl2)=$\frac{1}{2}$n(NaCl)=$\frac{1}{2}$×0.2mol=0.1mol,还有0.2mol电子是氢氧根离子转移的,生成n(O2)=$\frac{0.2mol}{4}$=0.05mol,则阳极生成气体体积=(0.1+0.05)mol×22.4L/mol=3.36L;电解过程分为两步:第一步电解反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、第二步电解反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,
根据Na原子守恒得n(NaOH)=n(NaCl)=0.2mol,c(NaOH)=$\frac{0.2mol}{2L}$=0.1mol/L,则溶液pH=13,故答案为:3.36L;13.
点评 本题以电解原理为载体考查计算,为高频考点,明确各个电极上发生的反应是解本题关键,注意③题阳极产物成分及其物质的量,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
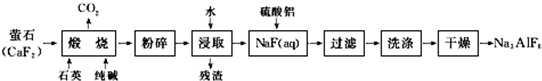
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对水加热到100℃,测得pH=6 | B. | 在水中滴入稀硫酸 | ||
| C. | 在水中加入小苏打 | D. | 在水中加入氯化铝固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成均匀的无色溶液 | B. | 形成均匀的紫红色溶液 | ||
| C. | 液体分层,上下层均呈无色 | D. | 液体分层,下层呈紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com