
分析 A、B、C、D、E是短周期元素,它们的原子序数逐渐增大,A元素原子形成的离子没有电子,则A应为H元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,应是氢氧化铝与强酸、强碱的反应,而A与C同主族,则C为Na元素、D为Al元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素,B与E同主族,则B为O元素,据此解答.
解答 解:A、B、C、D、E是短周期元素,它们的原子序数逐渐增大,A元素原子形成的离子没有电子,则A应为H元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,应是氢氧化铝与强酸、强碱的反应,而A与C同主族,则C为Na元素、D为Al元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素,B与E同主族,则B为O元素,
(1)A的离子符号是H+,故答案为:H+;
(2)E的低价氧化物为SO2,C的最高价氧化物的水化物为NaOH,少量二氧化硫与氢氧化钠反应生成亚硫酸钠与水,反应离子方程式为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
(3)A、B、C三种元素形成的化合物为NaOH,钠离子与氢氧根离子以离子键结合,O、H原子之间以共价键结合,故答案为:离子键、共价键;
(4)B、C、D三种元素的离子分别为O2-、Na+、Al3+,三种离子核外电子排布相同,离子的核电核数越大,则半径越小,故离子半径O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)E的氢化物与其低价氧化物反应方程式为:2H2S+SO2=3S↓+H2O,生成3molS时参加反应的二氧化硫为1mol,二氧化硫中S元素由+4价降低为0价,故转移电子数为1mol×4×6.02×1023mol-1=4×6.02×1023,故答案为:4×6.02×1023.
点评 本题考查位置结构性质的相互关系及应用,推断元素是解题关键,侧重考查学生对基础知识的理解掌握,难度不大.


科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验结论 |
(1)A的质谱图如图: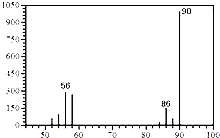 | (1)证明A的相对分子质量为:90. |
| (2)将此9.0g A在足量纯O 2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中. 往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO 2 (标准状况). 往另一份A中加入足量的金属钠充分反应,生成2.24 L H 2(标准状况). | (3)证明A的分子中含有一个羧基和一个羟基. |
(4)A的核磁共振氢谱如图: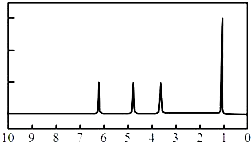 | (4)A的结构简式为:  . . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙醇 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
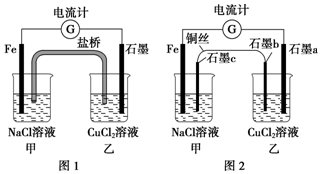 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )| A. | 图2中电流计指针偏转方向与图1中相同 | |
| B. | 图2中石墨a上有铜生成 | |
| C. | 向图2中甲装置石墨c附近滴加酚酞试液,出现红色 | |
| D. | 图2中电子流向为Fe→电流计→石墨a→石墨b→铜丝→石墨c→Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
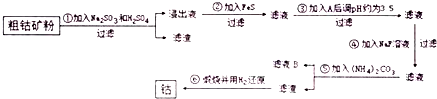
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | C--C | C=C | C--H | H一H |
| 键能(KJ•mol-1) | 348 | 610 | 413 | 436 |
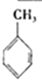 (g)+3H2(g)→
(g)+3H2(g)→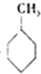 (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C的质量数为14g•mol-1 | B. | 14C与14N中子数一定不同 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与12C是两种不同的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com