
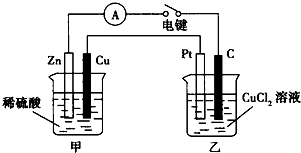
 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流表的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流表的指针发生了偏转.| 142 |
| 322 |
| 142w |
| 322 |
| ||
| ||
| w+36a |
| 142w |
| 322(w+36a) |
| 142w |
| 322(w+36a) |


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
| A、取25 g CuSO4?5H2O溶于1 L水中 |
| B、将CuSO4?5H2O干燥去掉结晶水,取16g溶于水制成1 L溶液 |
| C、将25 g CuSO4?5H2O溶于水制成1 L溶液 |
| D、将16 gCuSO4?5H2O溶于水配成1 L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
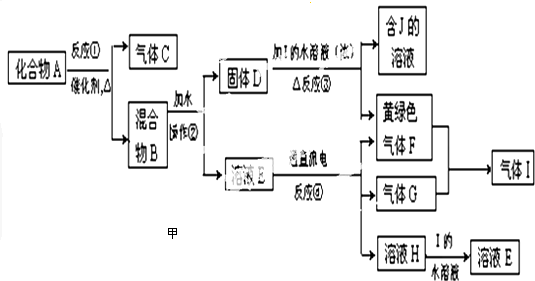
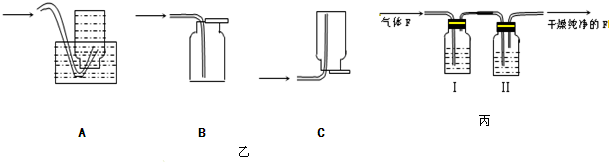
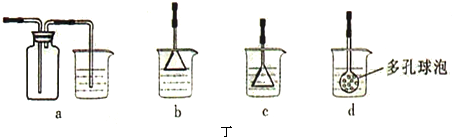
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、①③④ | B、③⑤⑦ |
| C、②④⑥ | D、只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、H+、NO3- |
| B、K+、CO32-、OH- |
| C、CO32-、OH-、NO3- |
| D、K+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com