
| A. | c1:c2=1:3 | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡 | |
| C. | X、Y的转化率不相等 | |
| D. | Y起始浓度c2可能为0.36mol/L |
分析 若反应向正反应进行到达平衡,X、Y的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X(气)+3Y(气)?2Z(气),
开始(mol/L):c1 c2 c3
变化(mol/L):0.04 0.12 0.08
平衡(mol/L):0.1 0.3 0.08
c1=0,14 c2=0.42,c3=0,
若反应逆正反应进行到达平衡,X、Y的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X(气)+3Y(气)?2Z(气),
开始(mol/L):c1 c2 c3
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.1 0.3 0.08
c1=0,c2=0,c3=0.28,
由于为可逆反应,物质不能完全转化所以起始时浓度范围为0<c(X)<0.14,0<c(Y)<0.42,0<c(Z)<0.28,
以此解答该题.
解答 解:A.X 和Y平衡浓度为1:3,变化的量为1:3,所以起始量为1:3,c1:c2=1:3,故A正确;
B.如达到平衡状态,则应满足4v(X)正=3v(Y)逆时,而此时为4v(X)正=v(Y)逆时,说明逆反应速率较大,则平衡逆向移动,故B正确;
C.由以上分析可知X、Y的变化量之比和起始量之比相同,所以转化率相同,故C错误;
D.由以上分析可知Y起始浓度范围为0<c(Y)<0.42,则Y起始浓度c2可能为0.36mol/L,故D正确.
故选C.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,易错点为D,注意可逆反应的特点,解题中还要注意化学反应计量数的关系为解答该题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeC13和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| B. | 其他条件不变,向稀H2SO4与过量Zn的混合物中加少量铜片,既能增大H2生成速率,又能减小生成H2的物质的量 | |
| C. | 其他条件不变,加热或加压都能使H2(g)+I2(g)?2HI(g)的v正和v逆同时增大 | |
| D. | v=$\frac{△c}{△t}$是化学上表示化学反应速率的唯一方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始物质的量/mol | 4分钟后平衡时的物质的量/mol | 平衡时放出的热量/kJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4 mol•L-1•min-1 | |
| B. | 平衡时,放出的热量为:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
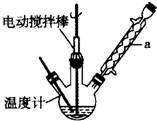 甲苯(
甲苯(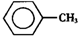 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(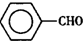 )、苯甲酸(
)、苯甲酸(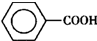 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
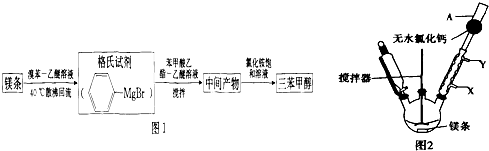
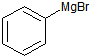 +H2O→
+H2O→ +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:
连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | |
| D. | 25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com