
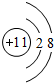 ,C的原子结构示意图是
,C的原子结构示意图是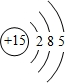 .
.分析 A、B、C、D四种元素的原子序数均小于18,B的原子核外次外层电子数为2,即B原子核外有2个电子层,最高正化合价为+4,故B为碳元素;A、C原子的核外次外层电子数为8,均处于第三周期,最高正化合价依次为+1、+5,故A为Na、C为P元素;D元素最高价为+7,最高价氧化物对应的水化物是已知含氧酸中最强酸,则D为Cl,据此解答.
解答 解:A、B、C、D四种元素的原子序数均小于18,B的原子核外次外层电子数为2,即B原子核外有2个电子层,最高正化合价为+4,故B为碳元素;A、C原子的核外次外层电子数为8,均处于第三周期,最高正化合价依次为+1、+5,故A为Na、C为P元素;D元素最高价为+7,最高价氧化物对应的水化物是已知含氧酸中最强酸,则D为Cl.
(1)由上述分析可知,A、B、C、D的名称分别是钠、碳、磷、氯,故答案为:钠;碳;磷;氯;
(2)A为钠元素,则钠离子的质子数为11,核外电子数为10,有2个电子层,最外层电子数为8,其离子结构示意图为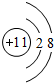 ;
;
C为磷元素,其质子数为15,有3个电子层,最外层电子数为5,其原子结构示意图为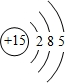 ,
,
故答案为: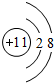 ;
;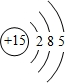 ;
;
(3)非金属性Cl>P,故氢化物稳定性:HCl>PH3,故答案为:HCl;PH3.
点评 本题考查位置结构性质的关系,注侧重对化学用语的考查,利用已知信息推出各元素是解答本题的关键,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液 | B. | 新制的氢氧化铜 | C. | 溴水 | D. | 氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHA溶液一定呈酸性 | B. | c(H+)•c(OH-)=1×10-14x | ||
| C. | c(Na+)=c(K+) | D. | c(Na+)+c(K+)=0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液,定容时俯视刻度线 | |
| B. | 测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 | |
| C. | 中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 | |
| D. | 在敞口容器中测量氢氧化钠和稀盐酸反应的中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 | |
| B. | Na2O2与水反应,红热的Fe与水蒸气反应均能生成气体 | |
| C. | Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
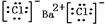 ,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;
,①中形成沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同位素 | B. | 同分异构体 | C. | 同系物 | D. | 同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2Cl6 | B. | ICl5 | C. | HClO | D. | KIO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com