
| A. | 萃取溴水中的溴,将四氯化碳和溴水混合后,振荡并打开分液漏斗瓶塞,使漏斗内气体放出 | |
| B. | 在蔗糖中加入浓硫酸时,蔗糖变黑,证明浓硫酸具有脱水性 | |
| C. | 向Ba(NO3)2溶液中通入SO2气体,产生白色沉淀,可推测SO2与可溶性钡盐均能反应产生白色沉淀 | |
| D. | 若要检验铜和浓硫酸反应后产物硫酸铜,可向反应后的试管中加入少量水,观察溶液是否变蓝,若变蓝则证明有硫酸铜生成 |
分析 A.依据萃取的正确操作解答;
B.依据浓硫酸具有脱水性解答;
C.二氧化硫与氯化钡不反应;
D.依据浓硫酸稀释的正确操作解答.
解答 解:A.萃取溴水中的溴,将四氯化碳和溴水混合振荡,振荡完成后,将瓶倒置,转动活塞,将气体放出,故A错误;
B.在蔗糖中加入浓硫酸时,蔗糖变黑,证明浓硫酸具有脱水性,故B正确;
C.向Ba(NO3)2溶液中通入SO2气体,产生白色沉淀,是因为二氧化硫被氧化生成硫酸根离子,不能推测SO2与可溶性钡盐均能反应产生白色沉淀,例如二氧化硫与氯化钡不反应,故C错误;
D.若要检验铜和浓硫酸反应后产物硫酸铜,应把反应产物倒出来放入另一个试管中加水,若直接加水浓硫酸稀释产生大量的热,不安全,故D错误;
故选:B.
点评 本题考查了实验基本操作及评价,明确萃取分液、浓硫酸稀释的正确操作是解题关键,注意浓硫酸吸水性与脱水性区别,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH2Cl2中含有C-Cl键数目为0.2NA | |
| B. | 常温常压下,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA | |
| C. | 常温常压下,10g92%酒精水溶液含氧原子总数为0.2NA | |
| D. | 常温常压下,0.1molNa2O2与水完全反应转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟盐酸的反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铵固体和熟石灰共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向碳酸钙中加入盐酸 CO32-+2H+═H2O+CO2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应 Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
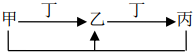 甲、乙、丙、丁四种物质中,甲、乙、丙含有相同的某种元素,它们之间有如下转化关系,则下列有关物质的推断错误的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙含有相同的某种元素,它们之间有如下转化关系,则下列有关物质的推断错误的是( )| A. | 若甲为焦炭,则丁可能是O2 | |
| B. | 若甲为NaOH溶液,则丁可能是CO2 | |
| C. | 若甲为铝盐溶液,则丁可能是NaOH溶液 | |
| D. | 若甲为Fe,则丁可能是氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
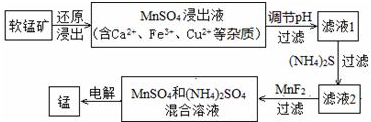
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=0.4 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| B. | PH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 新鲜的空气中:SO2、NO、N2、NH3 | |
| D. | 所有氯气的集气瓶中:H2S、H2、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| B. | 实验室制取氯气时,为了防止污染,多余氯气用氢氧化钙溶液吸收 | |
| C. | 新制氯水的酸性强于久置氯水 | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com