
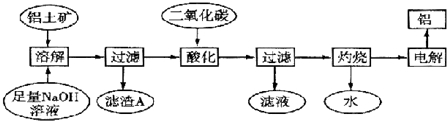
分析 (1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水.
(2)Al2O3、SiO2、Fe2O3用碱溶的方法分开.首先除掉不反应的Fe2O3,根据题中已知条件②除掉Na2SiO3.从而生成Na2Al2Si2O8,所以滤渣有两种.氧化物的形式是:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,注意原子个数的比例与原化学式中相同.
(3)通入二氧化碳酸化将NaAlO2转化成Al(OH)3,考查了氢氧化铝溶于强酸不溶于弱酸的知识.
(4)计算质量分数时用原子守恒法解,这是关系式:2Al~Al2O3,已知铝的质量,可算出铝的物质的量n(Al),再利用关系式算三氧化二铝的物质的量,n(Al2O3)=$\frac{1}{2}$n(Al),
Al2O3的质量为m=n(Al2O3)•M(Al2O3),所以Al2O3的质量分数为Al2O3的质量除以铝土矿的总质量.
(5)铁、铝遇浓硫酸、浓硝酸会钝化,稀硝酸与铝反应产生有毒气体.
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目.
解答 解:(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水.
故答案为:2OH-+Al2O3═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O
(2)由于氢氧化钠是足量的,所以Al2O3和SiO2充分反应,生成Na2SiO3和NaAlO2,
而铝土矿的主要成分是Al2O3,SiO2少量,那么生成的Na2SiO3少,NaAlO2多,
发生反应2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH后,
滤渣有之前不反应的Fe2O3和生成的Na2Al2Si2O8,滤液中有NaOH、余下大量的NaAlO2;
氧化物的形式是:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,注意原子个数的比例与原化学式中相同,
写成Na2O•Al2O3.•2SiO2.
故答案为 Fe2O3、Na2Al2Si2O8 Na2O•Al2O3.•2SiO2
(3)从第2小题的分析可知滤液中的NaAlO2要转化成Al(OH)3不能用盐酸,盐酸是强酸,
强酸过量后Al(OH)3会溶解.
故答案为:盐酸是强酸,Al(OH)3溶于强酸而不溶于弱酸,通入二氧化碳是为了提高Al2O3的提取率.
(4)已知铝nkg,可算出铝的物质的量,n(Al)=$\frac{1000n}{27}$ mol,根据原子守恒:2Al~Al2O3,三氧化二铝的物质的量n(Al2O3)=$\frac{1}{2}$n(Al),
n(Al2O3)=$\frac{1000n}{27×2}$,所以Al2O3的质量为
m=n(Al2O3)•M(Al2O3)=$\frac{1000n}{27×2}$ mol×102 g•mol-1 =$\frac{51000n}{27}$ g,所以Al2O3的质量分数为Al2O3的质量除以铝土矿的总质量,即$\frac{51000n}{27}$÷1000m=$\frac{51n}{27m}$;质量分数一般要乘以100%.
故答案为:$\frac{5100n}{27m}$% 或$\frac{1700n}{9m}$%.
(5)铁、铝遇浓硫酸、浓硝酸会钝化,稀硝酸与铝反应产生有毒气体,且等量的铝溶解消耗稀硝酸更多,消耗稀硫酸更少,从环保、节约的角度考虑,应用稀硫酸溶解铝.
故选B.
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目,这里的配位原子是氟原子,有6个.
故答案为:[AlF6]3-;6.
点评 除掉Fe2O3不难分析,关键是SiO2转化成Na2SiO3后,怎样除掉Na2SiO3?学生不能用题中信息解决这个问题.计算质量分数时利用原子守恒这是解题常用的方法,在处理数据以及单位时要特别小心.浓硫酸与浓硝酸的强氧化性的考查,同时要求学生要有化学与环境保护的思想.配位化合物的考查一般都很简单.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 600 | 700 |
| 平衡常数 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | V=40 | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
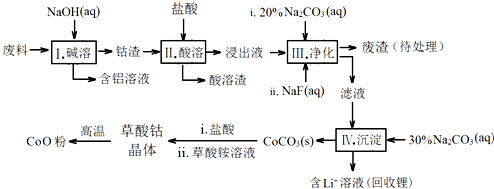
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中存在的共价键总数为0.1NA | |
| B. | 2.4g石墨中含有C-C键个数为0.4NA | |
| C. | 标准状况下,22.4LCC14中所含分子数为NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com