
| A. | 10g质量分数为46%的乙醇水溶液中所含原子数目为0.6NA | |
| B. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| C. | 常温常压下.4.4gN2O与CO2的混合气体中含的原子数目为0.3NA | |
| D. | 常温下,1molC5H12中含有共价键数为16NA |
分析 A.水也是由原子构成的;
B.常温常压下,气体的摩尔体积大于22.4L/mol;
C.N2O与CO2的摩尔质量相同,都是三原子分子;
D.一个C5H12中含有共价键数为4+3×4=16.
解答 解:A.10g质量分数为46%的乙醇水溶液中,乙醇所含原子数目为0.6NA,由于水中也含有原子,所以该溶液中含有的原子数目大于0.6NA,故A错误;
B.常温常压下,气体的摩尔体积大于22.4L/mol,因此11.2L乙烯的物质的量小于0.5mol,分子数目小于0.5NA,故B正确;
C.N2O与CO2的摩尔质量均为44g/mol,所以混合气体的物质的量为$\frac{4.4g}{44g/mol}$=0.1mol,而且都是三原子分子,所以含有的原子数目为0.3NA,故C正确;
D.一个C5H12中含有共价键数为4+3×4=16,则1molC5H12中含有共价键数为16NA,故D正确;
故选A.
点评 本题考查阿伏伽德罗常数的计算,为高考热点,题目难度中等,侧重于物质的组成和基本公式的综合应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将0.1mol氨充分溶解在1L水中 | |
| B. | 将10g质量分数为98%的硫酸与990g水混合 | |
| C. | 将10mL•1mol•L-1的盐酸与90mL水充分混合 | |
| D. | 将25.0g胆矾(CuSO4•5H2O)溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘酒可使蛋白质变性,故能消毒杀菌 | |
| B. | 天然氨基酸能溶于强酸或强碱溶液,在两性化合物 | |
| C. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸中的大 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试纸在检测溶液时不需要湿润,而检测气体时必须湿润 | |
| B. | 焰色反应使用的铂丝通常可用稀硫酸清洗 | |
| C. | 碘水中的碘可以用酒精萃取 | |
| D. | 在实验室遇酸灼伤,用水洗后再用稀NaOH溶液浸洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl可用作食品调味剂 | |
| B. | 相同温度下NaHCO3溶解度大于Na2CO3 | |
| C. | Na2CO3的焰色反应呈黄色 | |
| D. | 工业上Na可用于制备钛、锆等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe与过量稀HNO3反应,电子转移数为2NA | |
| B. | 120g由NaHSO4和KHSO3组成的混合物含硫原子数为NA | |
| C. | 标准状况下,22.4LCH2Cl2含氯原子数为2 NA | |
| D. | 0.3mol/LAl(NO3)3溶液中含A13+数小于0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
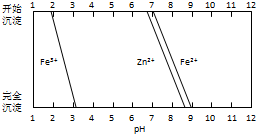 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com