
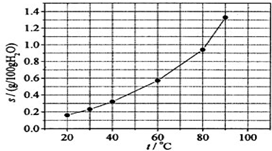
| A. | 温度升高时溴酸银溶解速度加快 | |
| B. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-4 | |
| D. | 溴酸银的溶解是放热过程 |
分析 A.温度升高,可以加快物质的溶解速率;
B.溴酸银的溶解度受温度的影响较小,可以通过重结晶法分离硝酸钾与溴酸银的混合物;
C.根据溶度积表达式及溶液中银离子和溴酸根离子的浓度计算;
D.根据图象中温度对溴酸银的溶解度影响可知溴酸银的溶解过程为吸热过程.
解答 解:A.升高温度,溴酸银的溶解度增大,所以温度升高时溴酸银溶解速度加快,故A正确;
B.根据图象可知,溴酸银的溶解度受温度的影响不大,而硝酸钾的溶解度受温度影响较大,所以硝酸钾中含有少量溴酸银,可用重结晶方法提纯,故B正确;
C.60℃时溴酸银的溶解度为0.6g,溴酸银的物质的量为:$\frac{0.6g}{236g/mol}$≈2.5×10-3mol,100.6g溴酸银溶液的体积约为100.6mL,溶液中银离子、溴酸根离子浓度约为2.5×10-2mol/L,所以60℃时溴酸银的Ksp=2.5×10-2×2.5×10-2≈6×10-4,故C正确;
D.根据图象可知,升高温度,溴酸银的溶解度增大,说明溴酸银的溶解过程为吸热过程,故D错误.
故选D.
点评 本题考查了难溶物的溶解平衡、溶度积的表达式及计算、物质的分离与提纯,为高频考点,侧重考查学生的分析、计算能力,题目难度中等,注意掌握难溶物的溶解平衡及其影响因素,明确溶度积的概念及计算方法.


科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二甲基-1-戊烯 | D. | 2-乙基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp(AB2)<Ksp(CD),则物质AB2的溶解度一定小于物质CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两清液混合,AgCl和AgI都沉淀 | |
| B. | 向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大 | |
| C. | 若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L | |
| D. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com