
 某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
某学生利用如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.| N |
| n |
| ||
| ||
| b |
| 2a |
| b |
| 2a |


科目:高中化学 来源: 题型:
- 2 |
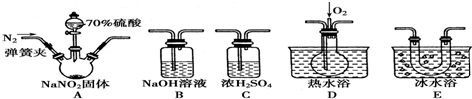
查看答案和解析>>
科目:高中化学 来源: 题型:
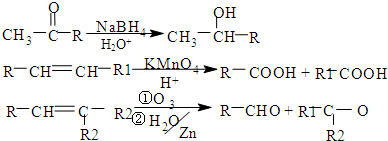

 和环状结构
和环状结构 是E的最简单的同系物.
是E的最简单的同系物.| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 铵盐质量 | 10.00g | 20.00g | 30.00g | 40.00g |
| 浓硫酸增加的质量 | a g | a g | 0.68g | 0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
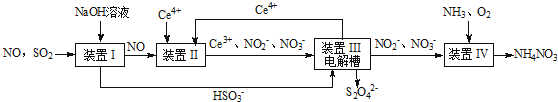

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲组和乙组实验能观察到相同的现象 |
| B、乙组和丙组实验均能观察到蓝色沉淀 |
| C、乙组实验产生的沉淀质量比丁组多 |
| D、戊组实验产生的沉淀质量比丙组少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应①属于加成反应 |
| B、W中至少含有1个手性碳原子 |
| C、X、Y、W、Z这四种物质中最多有三种能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别出X和W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com