
| V |
| Vm |
| 0.56L |
| 22.4L/mol |
| 1.4 |
| a |
| 1.4 |
| a |


科目:高中化学 来源: 题型:
| A、正反应速率增大逆反应速率减小,平衡向正反应方向移动 |
| B、正、逆反应速率都增大,平衡向正反应方向移动 |
| C、正、逆反应速率都增大,平衡向逆反应方向移动 |
| D、反应物的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时Ag2O参与反应的电极为负极 |
| B、充电时阴极的电极反应为:Zn(OH)2+2e-=Zn+2OH- |
| C、放电时正极附近的pH逐渐减小 |
| D、充电时每生成1 mol Ag2O转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④①②⑤③ |
| B、④①②③⑤ |
| C、①④②③⑤ |
| D、①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3:2 |
| B、2:3:3 |
| C、1:3:2 |
| D、3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3?2H++SO32- |
| B、HF=H++F- |
| C、NaHS=Na++H++S2- |
| D、H2CO3+H2O?H3O++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
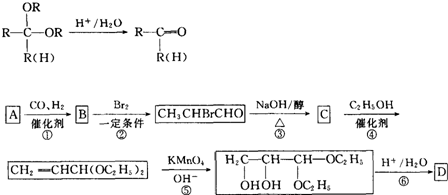
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com