
A、0.1mol羟基(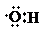 )中含有的电子数为0.7NA )中含有的电子数为0.7NA |
| B、1L 0.1mol?L-1的AlCl3溶液中含有Al3+的数目为0.1NA |
| C、0.1mol N2与足量H2反应,转移的电子数为0.6NA |
| D、标准状况下,1.12L HCHO中C原子的数目为0.05NA |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ca2+、Cl-、HCO3- |
| B、K+、Na+、NO3-、MnO4- |
| C、Mg2+、Na+、SO42-、Cl- |
| D、NH4+、Al3+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以石墨为电极,电解含甲基橙的0.01mol/L H2SO4溶液 |
| B、以铜为电极,电解1mol/L H2SO4溶液 |
| C、以石墨为电极,电解含酚酞的饱和NaCl溶液 |
| D、以石墨为电极,电解1mol/L的KBr溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、实验室用大理石和稀盐酸制取CO2:2H++C
| ||
| B、金属钠与足量水反应:Na+2H2O=Na++H2↑+2OH- | ||
C、氢氧化钡溶液中加入稀硫酸:Ba2++S
| ||
| D、Cl2与水反应:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、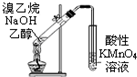 如图装置可用于证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 |
B、 如图装置能构成锌铜原电池 |
C、 如图装置可用于粗铜的电解精炼 |
D、 如图装置可用于在实验室测定中和反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
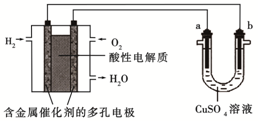
| A、燃料电池工作时,正极反应为:O2+4H++4e-═2H2O |
| B、a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C、a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出铜的质量相等 |
| D、a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
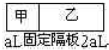 在甲、乙两容器中都充入1mol A 和2molB,反应3A(g)+B(g)?xC(g)达平衡后,甲容器中A的浓度与乙容器中A的浓度之比为5:3,则达平衡时甲与乙中C的体积分数大小为( )
在甲、乙两容器中都充入1mol A 和2molB,反应3A(g)+B(g)?xC(g)达平衡后,甲容器中A的浓度与乙容器中A的浓度之比为5:3,则达平衡时甲与乙中C的体积分数大小为( )| A、甲>乙 | B、甲<乙 |
| C、甲=乙 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com